
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Síndrome dos ovários poliquísticos.
Médico especialista do artigo
Última revisão: 04.07.2025
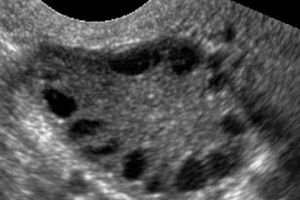
A síndrome dos ovários policísticos é uma patologia heterogênea multifatorial caracterizada por distúrbios do ciclo menstrual, anovulação crônica, hiperandrogenismo, alterações císticas nos ovários e infertilidade. A síndrome dos ovários policísticos é caracterizada por obesidade moderada, menstruação irregular ou amenorreia e sintomas de excesso de andrógenos (hirsutismo, acne). Os ovários geralmente contêm muitos cistos. O diagnóstico é baseado em testes de gravidez, níveis hormonais e exame para excluir um tumor virilizante. O tratamento é sintomático.
Causas síndrome dos ovários poliquísticos
A síndrome dos ovários policísticos é uma patologia endócrina comum do sistema reprodutor, ocorrendo em 5 a 10% das pacientes; é caracterizada por anovulação e excesso de andrógenos de etiologia desconhecida. Os ovários podem apresentar tamanho normal ou aumentados, com uma cápsula lisa e espessada. Em geral, os ovários contêm muitos cistos foliculares pequenos, de 26 mm; às vezes, cistos grandes contendo células atrésicas são encontrados. Os níveis de estrogênio aumentam, o que leva a um risco aumentado de hiperplasia endometrial e, por fim, de câncer endometrial. Os níveis de andrógenos frequentemente aumentam, o que aumenta o risco de síndrome metabólica e hirsutismo.
 [ 13 ]
[ 13 ]
Patogênese
Mulheres com síndrome dos ovários policísticos (SOP) apresentam anormalidades no metabolismo de androgênios e estrogênios, além de comprometimento da síntese de androgênios. A doença é acompanhada por altas concentrações séricas de hormônios androgênicos, como testosterona, androstenediona, sulfato de desidroepiandrosterona e (DHEA-S). No entanto, níveis normais de androgênios podem, às vezes, ser determinados.
A SOP também está associada à resistência à insulina, hiperinsulinemia e obesidade. A hiperinsulinemia também pode levar à supressão da síntese de SHBG, o que, por sua vez, pode potencializar as características androgênicas.
Além disso, a resistência à insulina na SOP está associada à adiponectina, um hormônio secretado pelos adipócitos que regula o metabolismo lipídico e os níveis de glicose no sangue.
O aumento dos níveis de andrógenos é acompanhado por um aumento no efeito estimulante do hormônio luteinizante (LH) secretado pela hipófise anterior, o que leva ao crescimento das células da teca ovariana. Essas células, por sua vez, aumentam a síntese de andrógenos (testosterona e androstenediona). Devido à redução dos níveis de hormônio folículo-estimulante (FSH) em relação ao LH, as células granulares ovarianas não conseguem aromatizar andrógenos em estrogênios, o que leva à diminuição dos níveis de estrogênio e à subsequente anovulação.
Algumas evidências sugerem que os pacientes têm um comprometimento funcional do citocromo P450c17, 17-hidroxilase, que inibe a biossíntese de andrógenos.
A síndrome dos ovários policísticos é uma síndrome geneticamente heterogênea. Estudos com familiares de SOP comprovam a herança autossômica dominante. Recentemente, foi confirmada uma ligação genética entre SOP e obesidade. Uma variante do gene FTO (rs9939609, que predispõe à obesidade generalizada) está significativamente associada à suscetibilidade ao desenvolvimento de SOP. Polimorfismos do locus 2p16 (2p16.3, 2p21 e 9q33.3) associados à síndrome dos ovários policísticos foram identificados, bem como o gene que codifica o receptor do hormônio luteinizante (LH) e da gonadotrofina coriônica humana (hCG).
Sintomas síndrome dos ovários poliquísticos
Os sintomas da síndrome dos ovários policísticos começam durante a puberdade e diminuem com o tempo. Menstruação regular por algum tempo após a menarca exclui o diagnóstico de síndrome dos ovários policísticos. O exame geralmente revela muco cervical abundante (refletindo altos níveis de estrogênio). O diagnóstico de síndrome dos ovários policísticos pode ser suspeitado se a mulher apresentar pelo menos dois sintomas típicos (obesidade moderada, hirsutismo, menstruação irregular ou amenorreia).
A combinação mais comum de sintomas clínicos é:
- distúrbios do ciclo menstrual (oligomenorreia, sangramento uterino disfuncional, amenorreia secundária);
- anovulação;
- infertilidade;
- hirsutismo;
- distúrbio do metabolismo da gordura (obesidade e síndrome metabólica);
- diabetes;
- síndrome da apneia obstrutiva do sono.
O que está incomodando você?
Diagnósticos síndrome dos ovários poliquísticos
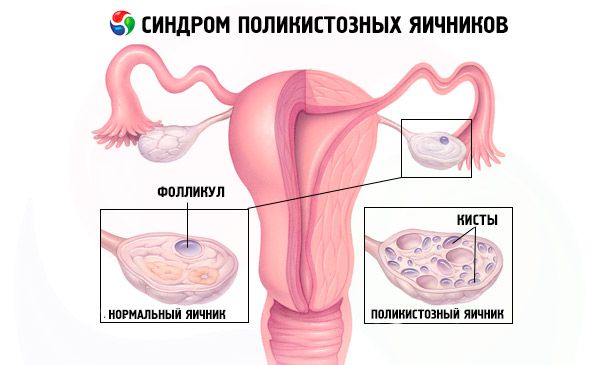
O diagnóstico baseia-se na exclusão de gravidez (teste de gravidez) e na análise de estradiol, FSH, TSH e prolactina no soro sanguíneo. O diagnóstico é confirmado por ultrassonografia, que revela mais de 10 folículos no ovário; os folículos geralmente são encontrados na periferia e assemelham-se a um colar de pérolas. Se forem observados folículos nos ovários e hirsutismo, os níveis de testosterona e DHEAS devem ser determinados. Os níveis patológicos são avaliados como na amenorreia.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
História e exame físico
Por meio de uma anamnese criteriosa, são identificados os fatores hereditários para o desenvolvimento da síndrome dos ovários policísticos. Durante o exame, são calculados o índice de massa corporal e a relação cintura-quadril (normalmente ≤ 0,8) para diagnosticar excesso de peso e obesidade.
A síndrome dos ovários policísticos é caracterizada pelo polimorfismo dos sinais clínicos e laboratoriais.
Métodos diagnósticos especiais para síndrome dos ovários policísticos
Um estudo hormonal é obrigatório do 3º ao 5º dia da reação semelhante à menstrual: são determinados os níveis sanguíneos de LH, FSH, prolactina, testosterona, andrógenos adrenais - DHEAS e 17-hidroxiprogesterona. A síndrome dos ovários policísticos é caracterizada por um índice LH/FSH elevado -> 2,5–3 (devido ao aumento dos níveis de LH) e hiperandrogenismo.
Para esclarecer a origem do hiperandrogenismo, um teste de ACTH é realizado para diagnóstico diferencial com hiperandrogenismo causado por uma mutação do gene que codifica a enzima 21-hidroxilase nas glândulas suprarrenais (diagnóstico das formas latentes e latentes da síndrome adrenogenital). Técnica: às 9h, o sangue é coletado da veia cubital, em seguida, 1 mg do medicamento Synacthen-depot é administrado por via intramuscular e, após 9 horas, o sangue é coletado novamente. A concentração de cortisol e 17-hidroxiprogesterona é determinada em ambas as porções de sangue e, em seguida, um coeficiente é calculado usando uma fórmula especial, cujos valores não devem exceder 0,069. Nesses casos, o teste é negativo e a mulher (ou o homem) não é portadora da mutação do gene 21-hidroxilase.
O teste da difenina é realizado para detectar formas centrais da síndrome dos ovários policísticos e a possibilidade de tratamento com medicamentos neurotransmissores. Técnica do teste: a concentração inicial de LH e testosterona é determinada no sangue. Em seguida, a difenina é administrada em 1 comprimido, 3 vezes ao dia, durante 3 dias. Após esse período, a concentração desses mesmos hormônios é novamente determinada no sangue. O teste é considerado positivo se os níveis de LH e testosterona diminuírem.
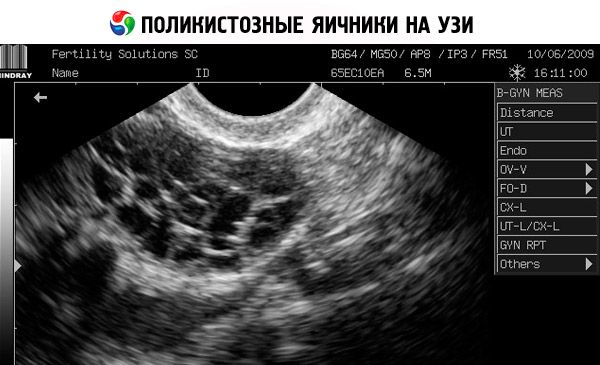
- A ultrassonografia dos genitais revela ovários aumentados (10 cm3 ou mais), múltiplos folículos de até 9 mm de diâmetro, espessamento do estroma ovariano e espessamento da cápsula.
- Além disso, se houver suspeita de resistência à insulina, um teste de tolerância à glicose é realizado para determinar os níveis de insulina e glicose antes e depois do exercício.
- Se houver suspeita de gênese adrenal da síndrome dos ovários policísticos, aconselhamento genético e genotipagem HLA são recomendados.
- Histerossalpingografia.
- Laparoscopia.
- Avaliação da fertilidade do esperma do cônjuge.
Em novembro de 2015, a Associação Americana de Endocrinologistas Clínicos (AACE), o Colégio Americano de Endocrinologia (ACE) e a Sociedade de Excesso de Andrógenos e SOP (AES) divulgaram novas diretrizes para o diagnóstico da SOP. Essas diretrizes são:
- Os critérios diagnósticos para SOP devem incluir um dos três critérios a seguir: anovulação crônica, hiperandrogenismo clínico e doença dos ovários policísticos.
- Além dos achados clínicos, os níveis séricos de 17-hidroxiprogesterona e do hormônio antimülleriano devem ser medidos para diagnosticar a SOP.
- Os níveis de testosterona livre são mais sensíveis na detecção do excesso de andrógenos do que os níveis de testosterona total.
O que precisa examinar?
Quem contactar?
Tratamento síndrome dos ovários poliquísticos
Mulheres com ciclos menstruais anovulatórios (histórico de menstruação ausente ou irregular e nenhuma evidência de produção de progesterona), sem hirsutismo e sem desejo de engravidar recebem um progestágeno intermitente (por exemplo, medroxiprogesterona 5 a 10 mg por via oral uma vez ao dia por 10 a 14 dias por mês durante 12 meses) ou anticoncepcionais orais para reduzir o risco de hiperplasia endometrial e câncer e para diminuir os níveis circulantes de andrógenos.
Mulheres com síndrome dos ovários policísticos com ciclos anovulatórios, hirsutismo e sem planejamento para engravidar devem receber tratamento para reduzir o hirsutismo e regular os níveis séricos de testosterona e DHEAS. Mulheres que desejam engravidar devem se submeter a tratamento para infertilidade.
O tratamento da infertilidade na síndrome dos ovários policísticos é realizado em 2 etapas:
- Etapa 1 - preparatória;
- Estágio 2 – estimulação da ovulação.
A terapia na fase preparatória depende da forma clínica e patogênica da síndrome dos ovários policísticos.
- Em casos de síndrome dos ovários policísticos e obesidade, recomenda-se prescrever medicamentos que ajudem a reduzir a resistência à insulina: o medicamento de escolha é a metformina, tomada por via oral na dose de 500 mg 3 vezes ao dia durante 3 a 6 meses.
- Na forma ovariana da síndrome dos ovários policísticos e níveis elevados de LH, são usados medicamentos que ajudam a reduzir a sensibilidade do sistema hipotálamo-hipófise à supressão completa da função ovariana (nível sérico de estradiol < 70 pmol/l):
- spray de buserelina, 150 mcg em cada narina 3 vezes ao dia a partir do 21º ou 2º dia do ciclo menstrual, curso de 1 a 3 meses, ou
- depósito de buserelina por via intramuscular 3,75 mg uma vez a cada 28 dias a partir do 21º ou 2º dia do ciclo menstrual, curso de 1 a 3 meses, ou
- leuprorrelina subcutânea 3,75 mg uma vez a cada 28 dias a partir do 21º ou 2º dia do ciclo menstrual, curso de 1 a 3 meses, ou
- triptorelina por via subcutânea 3,75 mg uma vez a cada 28 dias ou 0,1 mg uma vez ao dia a partir do 21º ou 2º dia do ciclo menstrual, curso de 1 a 3 meses.
Em princípio, não importa a partir de qual dia (21º ou 2º) do ciclo menstrual os agonistas de GnRH são prescritos; no entanto, a prescrição a partir do 21º dia é preferível, pois neste caso não se formam cistos ovarianos. Quando prescritos a partir do 2º dia do ciclo, a fase de ativação que precede a fase de supressão no mecanismo de ação do agonista de GnRH coincide com a fase folicular do ciclo e pode causar a formação de cistos ovarianos.
Drogas alternativas:
- etinilestradiol/dienogest por via oral 30 mcg/2 mg uma vez ao dia do 5º ao 25º dia do ciclo menstrual, curso de 3 a 6 meses ou
- etinilestradiol/acetato de ciproterona por via oral 35 mcg/2 mg uma vez ao dia do 5º ao 25º dia do ciclo menstrual, com duração de 3 a 6 meses.
- Na forma adrenal da síndrome dos ovários policísticos, a administração de medicamentos glicocorticoides é indicada:
- dexametasona por via oral 0,25–1 mg uma vez ao dia, curso de 3 a 6 meses, ou
- metilprednisolona por via oral 2–8 mg uma vez ao dia, curso de 3–6 meses, ou
- prednisolona por via oral 2,5–10 mg uma vez ao dia, curso de 3–6 meses.
- Para a forma central da síndrome dos ovários policísticos, são usados anticonvulsivantes:
- difenina 1 comprimido por via oral 1-2 vezes ao dia;
- carbamazepina por via oral 100 mg 2 vezes ao dia, curso de 3 a 6 meses.
Na 2ª fase é realizada a estimulação da ovulação.
A escolha dos medicamentos e seus esquemas de administração são determinados levando em consideração dados clínicos e laboratoriais. Durante a indução da ovulação, são realizados exames ultrassonográficos cuidadosos e monitoramento hormonal do ciclo estimulado.
É inaceitável induzir a ovulação com qualquer medicamento sem monitoramento ultrassonográfico. É inadequado iniciar a indução da ovulação na presença de formações císticas nos ovários com diâmetro > 15 mm e espessura endometrial > 5 mm.
A indução da ovulação com clomifeno é indicada em mulheres jovens com histórico curto da doença e níveis suficientes de estrogênio (estradiol sérico < 150 pmol/l) e baixos níveis de LH (> 15 UI/l).
O clomifeno é prescrito por via oral 100 mg uma vez ao dia, do 5º ao 9º dia do ciclo menstrual, no mesmo horário.
Uma ultrassonografia de controle é realizada no 10º dia do ciclo, avaliando o diâmetro do folículo dominante e a espessura do endométrio. Os exames são realizados em dias alternados e, no período periovulatório, diariamente. Não é o dia do ciclo que importa, mas o tamanho do folículo principal: se o seu diâmetro for superior a 16 mm, é necessário realizar uma ultrassonografia diária até atingir 20 mm.
Regimes de tratamento alternativos (com efeito antiestrogênico pronunciado):
Esquema 1:
- clomifeno por via oral 100 mg 1 vez por dia do 5º ao 9º dia do ciclo menstrual no mesmo horário do dia +
- etinilestradiol (EE) por via oral 50 mcg 2 vezes ao dia do 10º ao 15º dia do ciclo menstrual ou
- estradiol por via oral 2 mg 2 vezes ao dia do 10º ao 15º dia do ciclo menstrual.
Esquema 2:
- clomifeno por via oral 100 mg 1 vez por dia do 3º ao 7º dia do ciclo menstrual no mesmo horário do dia +
- menotropinas por via intramuscular 75–150 UI uma vez ao dia no mesmo horário do 7º ao 8º dia do ciclo menstrual ou
- folitropina alfa por via intramuscular 75–150 UI uma vez ao dia no mesmo horário, a partir do 7º–8º dia do ciclo menstrual.
A indução da ovulação com citrato de clomifeno não é indicada nas seguintes situações:
- no hipoestrogenismo (nível sérico de estradiol < 150 pmol/l);
- após preparação preliminar com agonistas de GnRH (como resultado da diminuição da sensibilidade do sistema hipotálamo-hipófise-ovariano, desenvolve-se hipoestrogenismo);
- Em mulheres em idade reprodutiva avançada, com histórico prolongado da doença e níveis séricos elevados de LH (> 15 UI/L). Não é apropriado aumentar a dose de clomifeno para 150 mg/dia durante ciclos de estimulação repetidos, pois o efeito antiestrogênico periférico negativo aumenta.
Não é recomendado realizar mais de 3 ciclos consecutivos de estimulação com clomifeno; se o tratamento for ineficaz, devem ser utilizadas gonadotrofinas.
A estimulação da ovulação com gonadotrofinas é indicada na ausência de foliculogênese adequada após estimulação com clomifeno, na presença de efeito antiestrogênico periférico pronunciado e na saturação estrogênica insuficiente. Pode ser realizada tanto em pacientes jovens quanto em idade reprodutiva tardia.
Medicamentos de escolha:
- menotropinas por via intramuscular 150–225 UI uma vez ao dia do 3º ao 5º dia do ciclo menstrual no mesmo horário, curso de 7 a 15 dias ou
- urofolitropina por via intramuscular 150–225 UI uma vez ao dia do 3º ao 5º dia do ciclo menstrual no mesmo horário, com duração de 7 a 15 dias.
Medicamentos alternativos (para alto risco de desenvolver síndrome de hiperestimulação ovariana):
- Folitropina alfa, por via intramuscular, 100-150 UI uma vez ao dia, do 3º ao 5º dia do ciclo menstrual, no mesmo horário, com duração de 7 a 15 dias. A indução da ovulação com gonadotrofinas utilizando análogos de GnRH é indicada na presença de síndrome dos ovários policísticos com níveis séricos elevados de LH (> 15 UI/L).
Medicamentos de escolha:
- buserelina na forma de spray de 150 mcg em cada narina 3 vezes ao dia a partir do 21º dia do ciclo menstrual ou
- depósito de buserelina por via intramuscular 3,75 mg uma vez no 21º dia do ciclo menstrual;
- leuprorrelina por via subcutânea 3,75 mg uma vez no 21º dia do ciclo menstrual;
- triptorelina por via subcutânea 3,75 mg uma vez no 21º dia do ciclo menstrual ou 0,1 mg uma vez ao dia a partir do 21º dia do ciclo menstrual +
- menotropinas por via intramuscular 225–300 UI uma vez ao dia do 2º ao 3º dia do ciclo menstrual subsequente no mesmo horário.
Medicamentos alternativos (para alto risco de desenvolver síndrome de hiperestimulação ovariana):
- menotropinas por via intramuscular 150–225 UI uma vez ao dia do 2º ao 3º dia do ciclo menstrual no mesmo horário ou
- folitropina alfa por via intramuscular 150–225 UI uma vez ao dia do 2º ao 3º dia do ciclo menstrual no mesmo horário +
- ganirelix por via subcutânea 0,25 mg uma vez ao dia, a partir do 5º ao 7º dia de uso de gonadotrofina (quando o folículo dominante atinge um tamanho de 13 a 14 mm);
- cetrorelix por via subcutânea 0,25 mg uma vez ao dia, a partir do 5º ao 7º dia de uso de gonadotrofina (quando o folículo dominante atinge um tamanho de 13–14 mm).
Indução da ovulação em pacientes em idade reprodutiva tardia (com resposta ovariana fraca a medicamentos gonadotrópicos).
Medicamentos de escolha:
- menotropinas por via intramuscular 225 UI uma vez ao dia do 3º ao 5º dia do ciclo menstrual no mesmo horário +
- triptorelina por via subcutânea 0,1 mg uma vez ao dia a partir do 2º dia do ciclo menstrual.
Drogas alternativas:
- triptorelina por via subcutânea 0,1 mg uma vez ao dia a partir do 2º dia do ciclo menstrual +
- folitropina alfa por via intramuscular 200–225 UI uma vez ao dia do 3º ao 5º dia do ciclo menstrual no mesmo horário.
Em todos os esquemas que utilizam gonadotrofinas, a adequação da dose destas é avaliada pela dinâmica do crescimento folicular (normalmente 2 mm/dia). Com crescimento folicular lento, a dose é aumentada em 75 UI; com crescimento muito rápido, é reduzida em 75 UI.
Em todos os esquemas, se houver um folículo maduro medindo 18–20 mm e a espessura endometrial for de pelo menos 8 mm, a terapia é interrompida e a gonadotrofina coriônica humana é administrada por via intramuscular em uma dose única de 10.000 UI.
Após a confirmação da ovulação, a fase lútea do ciclo é apoiada.
Medicamentos de escolha:
- didrogesterona oral 10 mg 1-3 vezes ao dia, curso de 10-12 dias ou
- Progesterona oral 100 mg 2 a 3 vezes ao dia, ou vaginal 100 mg 2 a 3 vezes ao dia, ou intramuscular 250 mg 1 vez ao dia, com duração de 10 a 12 dias. Medicamento alternativo (na ausência de sintomas de hiperestimulação ovariana):
- gonadotrofina coriônica humana por via intramuscular 1500–2500 UI uma vez ao dia nos dias 3,5 e 7 da fase lútea.
Outros medicamentos usados no tratamento da SOP:
- Antiandrogênios (por exemplo, espironolactona, leuprolida, finasterida).
- Medicamentos hipoglicemiantes (por exemplo, metformina, insulina).
- Moduladores seletivos do receptor de estrogênio (por exemplo, citrato de clomifeno).
- Medicamentos para acne (por exemplo, peróxido de benzoíla, creme de tretinoína (0,02-0,1%)/gel (0,01-0,1%)/solução (0,05%), creme de adapaleno (0,1%)/gel (0,1%, 0,3%)/solução (0,1%), eritromicina 2%, clindamicina 1%, sulfetamida de sódio 10%).
Efeitos colaterais do tratamento
Ao usar clomifeno, a maioria das pacientes desenvolve um efeito antiestrogênico periférico, que consiste no atraso do crescimento endometrial em relação ao crescimento folicular e na diminuição da quantidade de muco cervical. Ao usar gonadotrofinas, especialmente a gonadotrofina menopáusica humana (menotropinas), pode ocorrer síndrome de hiperestimulação ovariana (SHO); ao usar FSH recombinante (folitropina alfa), o risco de síndrome de hiperestimulação ovariana é menor. Ao usar regimes que incluem agonistas de GnRH (triptorelina, buserelina, leuprorrelina), o risco de síndrome de hiperestimulação ovariana aumenta, e o uso de agonistas de GnRH pode causar sintomas de deficiência de estrogênio – ondas de calor, pele e mucosas secas.
Previsão
A eficácia do tratamento da infertilidade na síndrome dos ovários policísticos depende das características clínicas e hormonais do curso da doença, da idade da mulher, da adequação da terapia preparatória e da seleção correta do regime de indução da ovulação.
Em 30% das mulheres jovens com histórico curto da doença, a gravidez pode ser alcançada após tratamento preparatório sem indução da ovulação.
A eficácia da estimulação da ovulação com clomifeno não ultrapassa 30% por mulher; 40% das pacientes com síndrome dos ovários policísticos são resistentes ao clomifeno.
O uso de menotropinas e urofolitropina permite a gravidez em 45–50% das mulheres, mas esses medicamentos aumentam o risco de desenvolver a síndrome de hiperestimulação ovariana.
Os mais eficazes são os esquemas que utilizam agonistas de GnRH, que permitem evitar picos "parasitários" de LH: até 60% das gestações por mulher. No entanto, com o uso desses medicamentos, observa-se o maior risco de complicações – formas graves de síndrome de hiperestimulação ovariana e gravidez múltipla. O uso de antagonistas de GnRH não é menos eficaz, mas não está associado a um alto risco de síndrome de hiperestimulação ovariana.
 [ 34 ]
[ 34 ]

