
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Anemia hipofisária (nanismo)
Médico especialista do artigo
Última revisão: 12.07.2025
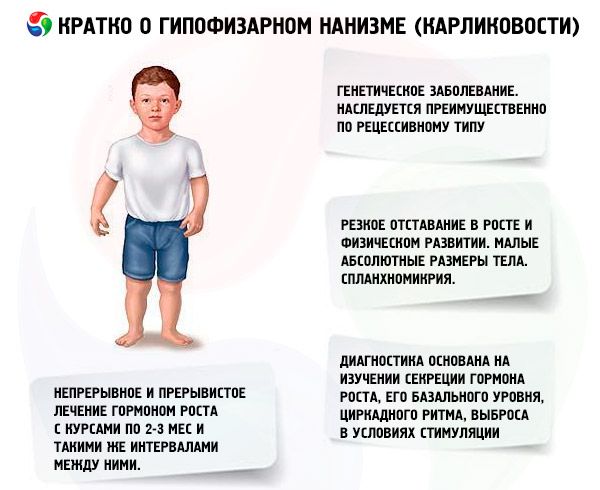
O termo "nanismo hipofisário" (do grego nanos - anão; sin.: nanismo, nanosomia, microsomia) no sentido absoluto significa uma doença cuja principal manifestação é um retardo acentuado no crescimento, associado a uma violação da secreção do hormônio do crescimento pela glândula pituitária anterior.
Em um sentido mais amplo, o nanismo é um distúrbio do crescimento e do desenvolvimento físico, cuja ocorrência pode ser causada não apenas por uma deficiência absoluta ou relativa do hormônio somatotrópico devido à patologia da própria glândula pituitária, mas também por um distúrbio da regulação hipotalâmica (cerebral) de suas funções, defeitos na biossíntese do hormônio somatotrópico e distúrbios da sensibilidade do tecido a esse hormônio.
Causas nanismo
A maioria das formas de nanismo hipofisário são doenças genéticas. A mais comum é o nanismo pan-hipopituitário, que é herdado principalmente de forma recessiva. Supõe-se que existam dois tipos de transmissão dessa forma de patologia - autossômica e através do cromossomo X. Nessa forma de nanismo, juntamente com o defeito na secreção do hormônio somatotrópico, a secreção de gonadotrofinas e do hormônio estimulante da tireoide é mais frequentemente interrompida. A secreção de ACTH é interrompida com menos frequência e em menor extensão. Estudos funcionais com hormônios liberadores, incluindo o hormônio liberador de somatotropina sintético (composto por 29, 40 e 44 resíduos de aminoácidos), semelhante ao polipeptídeo pancreático, mostraram que a maioria desses pacientes tem patologia no nível do hipotálamo, e a insuficiência da glândula pituitária anterior é secundária. A patologia primária da própria hipófise é menos comum.
O nanismo genético com deficiência isolada de hormônio do crescimento, com atividade biológica e sensibilidade prejudicadas a ele, é encontrado esporadicamente na Rússia e em países vizinhos. É mais comum nas Américas, nos países do Oriente Próximo e Médio e na África. Com base nos resultados de um estudo sobre o conteúdo sanguíneo de hormônio somatotrópico e a sensibilidade dos pacientes ao hormônio somatotrópico exógeno, os níveis de insulina imunorreativa (IRI), fatores de crescimento semelhantes à insulina (IGF) tipo I (somatomedina C) e tipo II, e a resposta do IGF-1 ao tratamento com preparações de hormônio somatotrópico, diversas variantes de tipos clinicamente semelhantes de nanismo foram identificadas.
Recentemente, a patogênese do nanismo de Laron, que é causado por uma deficiência de IRF-1 e IRF-II, foi decifrada, bem como a patogênese do nanismo em pigmeus africanos, associada a uma deficiência do primeiro.
Em 1984, foi descrita uma nova variante do nanismo pseudo-hipofisário com alto nível de hormônio somatotrópico e IGF-1; a gênese do nanismo é explicada por um defeito em seus receptores, o que é comprovado por uma diminuição acentuada na ligação dos fibroblastos da pele ao IGF-1.
Deve-se ressaltar que nas condições modernas, com a presença de famílias pequenas, muitos casos isolados (“idiopáticos”, esporádicos) da doença também podem ser genéticos.
Na análise de 350 prontuários, a etiologia do nanismo não foi esclarecida em 228 pacientes (65,2%). Este grupo incluiu pacientes de 57 famílias com incidência repetida de nanismo (2 a 4 casos por família), o que representou 28% de todos os pacientes. Em 77% das famílias com formas etiologicamente incertas (principalmente genéticas) de nanismo, foi estabelecida uma conexão inegável com a herança da ausência do fator Rh. A distribuição do fator Rh em famílias de pacientes com nanismo difere daquela observada no conflito Rh entre a mãe e o feto e, via de regra, não é acompanhada de doença hemolítica do recém-nascido (o pai pode ser Rh negativo e, no caso de heterozigosidade dos pais para o fator Rh, os filhos, etc.). É possível supor uma conexão entre a atividade dos genes responsáveis pela síntese do hormônio somatotrópico (ou hormônio liberador de somatotropina) e os genes que determinam o fator Rh, especialmente porque a maioria das formas de nanismo e a ausência do fator Rh são características autossômicas recessivas. Isso não explica a relativa raridade do nanismo em comparação com a frequência de indivíduos Rh negativos na população. Provavelmente, alguns fatores adicionais ainda desconhecidos são importantes, mas as características da distribuição do fator Rh em famílias de pacientes com nanismo familiar e esporádico provavelmente não são acidentais.
Um grande grupo de pacientes com nanismo (cerebral primário, cérebro-hipofisário) são pacientes com vários tipos de patologia orgânica do sistema nervoso central que surgiram no útero ou na primeira infância. O substrato anatômico que causa essa patologia pode ser o subdesenvolvimento ou ausência da glândula pituitária, sua distopia na patologia da formação da sela túrcica, degeneração cística da glândula pituitária, sua atrofia devido à compressão por um tumor (craniofaringioma, adenoma cromófobo, meningioma, glioma). O nanismo pode ser causado por lesões traumáticas na região hipotálamo-hipofisária (intrauterina, ao nascimento ou pós-natal), que frequentemente ocorrem em gestações múltiplas, bem como durante o parto em apresentação pélvica, apresentação do pé ou na posição transversa com rotação na perna (este é o mecanismo de parto em mais de 1/3 dos pacientes com nanismo). Danos infecciosos e tóxicos são importantes (infecções virais intrauterinas, tuberculose, sífilis, malária, toxoplasmose; doenças em idade precoce, sepse neonatal, meningoencefalite e aracnoencefalite, etc.). Esses processos podem danificar a própria hipófise, os centros hipotalâmicos que regulam sua função e interromper as conexões funcionais normais no sistema nervoso central.
Lesões fetais intrauterinas podem levar ao nascimento de pacientes com “nanismo de nascença” com secreção normal do hormônio do crescimento (nanismo primordial cerebral, microcefalia, nanismo de Silver-Russell com hemiassimetria corporal e altos níveis de gonadotrofinas, etc.).
Fatores adicionais que agravam a violação do desenvolvimento físico no nanismo podem ser nutrição inadequada, desequilibrada em termos de ingredientes essenciais (deficiência de proteína) e microelementos (deficiência de zinco) e condições ambientais desfavoráveis, bem como várias doenças crônicas, como glomerulonefrite, na qual a azotemia afeta a atividade dos receptores do fígado ou afeta diretamente o metabolismo das células do fígado, causando uma diminuição na síntese de somatomedina, ou cirrose hepática, quando a formação de somatomedina é prejudicada.
Patogênese
Na maioria dos pacientes com nanismo hipofisário, as alterações não se limitam à patologia da secreção do hormônio somatotrópico e à sensibilidade a ele, mas se estendem a outros hormônios trópicos da glândula pituitária, o que causa várias combinações de distúrbios endócrinos e metabólicos.
Na deficiência isolada do hormônio somatotrópico, as alterações morfológicas da hipófise têm sido pouco estudadas. Nos casos estudados, foram raramente encontradas alterações patológicas (craniofaringioma ou hiperostose dos ossos cranianos). Nesse tipo de nanismo, pode ser observado um subdesenvolvimento congênito de células peptidérgicas ou um defeito no sistema neurotransmissor do hipotálamo. Nesses casos, o nanismo pode estar associado à displasia ou hipoplasia dos nervos ópticos. Cistos intrasselares e tumores hipofisários e hipotalâmicos levam à deficiência de STH, causando compressão do tecido hipofisário, em particular dos somatotróficos.
O nanismo é caracterizado pelo afinamento dos ossos, principalmente devido à camada cortical, ao atraso na diferenciação e ossificação do esqueleto. Os órgãos internos são hipoplásicos, às vezes atróficos, e os músculos são pouco desenvolvidos.
Sintomas nanismo
Um atraso acentuado no crescimento e no desenvolvimento físico são as principais manifestações do nanismo hipofisário. Os pacientes nascem com peso e comprimento normais e começam a apresentar atraso no crescimento a partir dos 2 a 4 anos de idade.
Antes do advento do tratamento ativo para nanismo, considerava-se anões aqueles com altura inferior a 120 cm para mulheres e 130 cm para homens. Atualmente, a altura de um anão difere em pelo menos 2 a 3 desvios sigma da norma tabular média para um determinado sexo, idade ou população. Existe também um método para avaliação gráfica da altura com base na curva de distribuição gaussiana. Nesse caso, os anões, por altura, são incluídos em um grupo que inclui o número mínimo de indivíduos na população correspondente com o maior atraso em relação à norma de crescimento média.
O nanismo hipofisário é caracterizado não apenas pelo pequeno tamanho corporal absoluto, mas também por uma dinâmica de crescimento e desenvolvimento físico anual reduzida. A constituição física é proporcional, mas as proporções corporais dos pacientes são típicas da infância. A pele é pálida, frequentemente com um tom amarelado, seca, o que se deve à insuficiência tireoidiana absoluta ou relativa. Por vezes, observa-se cianose – "marmoreio" da pele. Em pacientes não tratados, a pele com aspecto envelhecido e enrugado (gerodermia) surge precocemente. Isso se deve à insuficiência da ação anabólica do STH e à lenta mudança das gerações celulares.
Os cabelos na cabeça podem ser normais ou secos, finos e quebradiços; cílios longos são típicos. O crescimento capilar secundário frequentemente está ausente. O tamanho da sela túrcica na maioria dos pacientes com nanismo (70-75%) não se altera, mas a sela frequentemente mantém a forma infantil de uma "oval em pé", tem um dorso largo "juvenil" e o seio do osso esfenoide fica para trás em termos de pneumatização. No entanto, existem pacientes com sela túrcica aumentada, o que é um sinal de tumor; com áreas de calcificação em seu fundo ou na área de entrada (com craniofaringioma, efeitos residuais de neuroinfecção) ou sua diminuição (sinais de subdesenvolvimento, tamanho reduzido da hipófise). Sintomas de hipertensão intracraniana são observados: afinamento dos ossos da abóbada craniana, aumento do padrão vascular, presença de impressões digitais, etc. O sinal mais importante do nanismo hipofisário é um atraso no tempo de diferenciação e ossificação do esqueleto. As características do sistema dentário também estão intimamente relacionadas à diferenciação esquelética: observa-se a substituição tardia dos dentes de leite. O maior atraso no desenvolvimento do sistema esquelético é observado em pacientes com nanismo, insuficiência sexual e hipotireoidismo.
Os genitais da maioria dos pacientes apresentam subdesenvolvimento grave, embora malformações sejam raras. Observamos criptorquidia em 5,8% dos pacientes do sexo masculino. A insuficiência sexual é acompanhada por subdesenvolvimento das características sexuais secundárias, diminuição do desejo sexual e ausência de menstruação. O desenvolvimento sexual espontâneo normal é observado apenas em pacientes com deficiência isolada de hormônio do crescimento e em alguns pacientes com nanismo cerebral.
A insuficiência tireoidiana é um sintoma bastante comum do nanismo. Deve-se observar que as manifestações externas do hipotireoidismo nem sempre refletem o verdadeiro estado funcional da glândula tireoide. Isso se deve ao hipotireoidismo relativo, causado pela interrupção da transição de tiroxina (T4 ) para triiodotironina (T3 ) e pela formação de T3 inativo (reversível) , característico da insuficiência somatotrópica.
A função adrenocorticotrópica no nanismo hipofisário diminui com menos frequência e em menor extensão do que as funções sexuais e de estimulação da tireoide e, na maioria dos pacientes, não requer correção especial.
Na maioria dos casos, o intelecto não é prejudicado. Alterações emocionais na forma de infantilismo mental são observadas; em pacientes mais velhos sem comprometimento intelectual, neuroses reativas são às vezes observadas.
Na patologia cerebral orgânica, especialmente de natureza tumoral, o nanismo pode ocorrer com sintomas de diabetes insípido, hemianopsia bitemporal e deficiência intelectual.
O estudo do desenvolvimento da atividade bioelétrica cerebral em pacientes sem sintomas orgânicos do sistema nervoso central mostrou que seu EEG é caracterizado por características de imaturidade, preservação a longo prazo de alta voltagem "infantil" do EEG; irregularidade do ritmo alfa em amplitude e frequência; aumento acentuado no conteúdo dos ritmos θ e δ lentos, especialmente nas derivações frontal e central; uma reação clara à hiperventilação; uma mudança na amplitude dos ritmos do EEG seguindo os ritmos da estimulação luminosa para baixas frequências (evidência de diminuição da mobilidade funcional das estruturas nervosas do cérebro). Foi revelado que, em pacientes mais velhos, a natureza imatura da atividade elétrica cerebral se deve ao subdesenvolvimento sexual e, em pacientes de todas as faixas etárias, ao hipotireoidismo.
O metabolismo de carboidratos em pacientes com nanismo é caracterizado por uma tendência à diminuição dos níveis de glicemia em jejum, aumento durante o esforço físico, insuficiência de insulina endógena, aumento da sensibilidade à insulina exógena com desenvolvimento frequente de condições hipoglicêmicas. Este último é explicado principalmente por níveis insuficientes de hormônios contra-insulares no corpo dos pacientes.
Órgãos internos apresentam esplancnomicria, ou seja, diminuição do tamanho. Não foram descritas alterações funcionais em órgãos internos específicas do nanismo. Hipotensão arterial com diminuição da pressão sistólica e diastólica e diminuição da amplitude de pulso é frequentemente observada. Os sons cardíacos são abafados, sopros funcionais de vários tópicos são ouvidos devido a alterações tróficas no miocárdio e distúrbios autonômicos. O ECG é caracterizado por baixa voltagem (especialmente na presença de hipotireoidismo), bradicardia sinusal ou bradiarritmia; o PCG mostra diminuição da amplitude dos tons, tons adicionais e sopros funcionais. Os dados da oxigemometria indicam hipoxemia (inicial e durante o esforço físico) e débito de oxigênio. Pacientes idosos às vezes desenvolvem hipertensão.
Diagnósticos nanismo
O diagnóstico e o diagnóstico diferencial do nanismo baseiam-se em dados de anamnese e em exames clínicos, radiológicos, laboratoriais e hormonais abrangentes. Além do tamanho corporal absoluto, para avaliar o crescimento dos pacientes, determina-se o déficit de crescimento – a diferença entre a altura do paciente e sua média para o sexo e a idade correspondentes; a idade de crescimento – a conformidade da altura do paciente com determinados padrões; o indicador de desvio normalizado.
I = M - Mcp / δ, onde M é a altura do paciente, Mcp é a altura normal média para um determinado gênero e idade, δ é o desvio quadrático de Mcp; I menor que 3 é típico de nanismo, I maior que 3 é típico de gigantismo. Este indicador pode ser usado para avaliar a dinâmica do desenvolvimento.
O exame radiográfico de pacientes com nanismo revela sinais de hipertensão intracraniana, efeitos residuais de neuroinfecção, calcificações e craniossinostose. O estudo do tamanho, forma e estrutura da sela túrcica é considerado um indicador indireto que caracteriza o tamanho da hipófise. Uma das manifestações mais importantes do retardo de crescimento patológico é a violação da diferenciação esquelética. Para avaliar o grau de maturidade esquelética, determina-se a idade óssea (radiográfica), que corresponde à diferenciação do tecido ósseo; a deficiência de ossificação é o grau de atraso da ossificação em relação ao normal (em anos); o coeficiente de ossificação é o quociente da divisão da idade óssea pelos parâmetros cronológicos e outros.
O diagnóstico moderno de nanismo é impossível sem o estudo da secreção do hormônio somatotrópico, seu nível basal, ritmo circadiano e liberação sob estimulação. A maioria dos pacientes com nanismo hipofisário é caracterizada por um conteúdo reduzido de hormônio somatotrópico no soro sanguíneo. Quando determinado pelo método radioimunológico, é (de acordo com diferentes autores) de (0,87 ± 0,09) a (1,50 ± 0,64) ng/ml, com uma norma média de (3,81 ± 0,29) ng/ml. Um estudo dos ritmos diários (circadianos) da secreção do hormônio somatotrópico mostrou que seu nível em pessoas saudáveis é máximo durante as primeiras 2 horas de sono e entre 4 e 6 da manhã. No nanismo, o conteúdo do hormônio somatotrópico é reduzido também durante essas horas.
Para estudar as reservas da função somatotrópica, são utilizados diversos estimulantes, examinando-se o conteúdo do hormônio somatotrópico antes e depois de sua administração. A coleta de sangue para o estudo é realizada a cada 30 minutos, durante 2 a 3 horas. A liberação do hormônio somatotrópico após a estimulação é considerada normal, no mínimo, até 7 a 10 ng/ml, podendo chegar a 20 a 40 ng/ml. Se não houver reação em uma das amostras, são realizados testes repetidos com outros estimulantes. A insuficiência do hormônio somatotrópico é considerada comprovada na ausência de liberação do hormônio somatotrópico em 2 a 3 amostras diferentes.
Os testes de estimulação mais comumente utilizados são: com a administração intravenosa de 0,1 U (0,75-1,5 U) de insulina por 1 kg de peso corporal do paciente e a obtenção de hipoglicemia (redução de 50% da glicemia em relação ao nível inicial), o hormônio somatotrópico sérico é determinado de acordo com o esquema acima. Se ocorrer hipoglicemia grave, o teste é interrompido e o paciente recebe glicose por via intravenosa. Este é o método diagnóstico clássico mais comum.
TRH na dose de 200-500 mcg por via intravenosa. Identifica eficazmente as reservas hormonais e não causa complicações. Em combinação com o teste de insulina, permite avaliar o nível de dano ao sistema hipotálamo-hipofisário. Uma reação positiva ao TRH na ausência de hipoglicemia por insulina indica a integridade da hipófise e danos ao nível hipotalâmico; reações negativas ao TRH e hipoglicemia indicam danos à própria hipófise.
TRH, LH-RH na dose de 300 mcg por via intravenosa é semelhante ao anterior.
O SGH humano é um análogo sintético de um composto biologicamente ativo isolado de um tumor pancreático. Atualmente, existem 3 tipos de SGH sintético: com 29, 40 e 44 resíduos de aminoácidos. É usado por via intravenosa em doses de 1 a 3 μg/kg de peso corporal do paciente. A liberação de SGH é observada 15 a 20 minutos após a administração, sendo o teste mais eficaz do que outros na revelação de reservas de hormônio do crescimento endógeno. Uma reação positiva para SGH indica um nível hipotalâmico de dano à função somatotrópica e uma glândula pituitária intacta; com aminoácidos (monocloreto de L-arginina, ornitina, triptofano, glicina, leucina) por via intravenosa na dose de 0,25 a 0,5 g por 1 kg de peso corporal do paciente. Eficaz para estudar as reservas de SGH. Pode causar reações alérgicas.
L-dopa por via oral na dose de 250-500 mcg. Eficaz e bem tolerado pelos pacientes.
Também são utilizados testes com glucagon, bromo ergocriptina (parlodel), lisina vasopressina, clonidina e carga ergométrica de bicicleta dosada.
O estudo do estado da função somatotrópica é necessário não apenas para o diagnóstico do nanismo, mas também para a escolha justificada de um método de terapia, uma vez que o tratamento com somatotropina é racional apenas no caso de insuficiência do hormônio do crescimento endógeno.
Para o diagnóstico da forma de nanismo, é muito importante estudar o conteúdo de fatores de crescimento semelhantes à insulina, ou somatomedinas (especialmente IGF-1 ou somatomedina C) – mediadores da ação do hormônio somatotrópico em nível tecidual. Sabe-se que o conteúdo de somatomedina C no nanismo está reduzido e, na acromegalia, está aumentado em comparação ao normal. A forma de nanismo descrita por Laron é um tipo de doença com produção normal de hormônio do crescimento (STH), mas com formação prejudicada de IGF-1 e IGF-II. O tratamento desses pacientes com somatotropina é inútil.
Indicadores indiretos da função somatotrópica da hipófise são a atividade da fosfatase alcalina e o conteúdo de fósforo inorgânico no soro. Em condições hipossomatotrópicas, esses indicadores são reduzidos. Na forma pan-hipo-hipofisária do nanismo, a secreção de gonadotrofinas, frequentemente TSH, é reduzida, o que é acompanhado por uma diminuição correspondente nas funções das glândulas sexuais (deficiência de andrógenos ou estrógenos), da glândula tireoide (diminuição dos níveis de T3 , T4 , iodo ligado a proteínas - PBI, acúmulo de 131 I pela glândula tireoide) e das glândulas suprarrenais (diminuição da quantidade de cortisol e 17-OCS no plasma, excreção de 17-KC e 17-OCS na urina, linfocitose).
Todos os tipos de nanismo hipofisário (hipotálamo-hipofisário) são caracterizados por doenças recorrentes em crianças de uma família com herança autossômica recessiva (mais frequentemente) ou autossômica dominante, retardo de crescimento e desenvolvimento físico de 2 a 4 anos, com um atraso de pelo menos 2 a 3% em relação às normas médias de crescimento para um determinado sexo, idade e população, com baixa dinâmica espontânea de crescimento anual e ossificação retardada. Com um baixo nível de hormônio somatotrópico (em 2 a 3 testes de estimulação abaixo de 7 ng/ml), a terapia com hormônio somatotrópico é altamente eficaz (proporciona um aumento na altura de pelo menos 7 cm por ano). Com um nível normal ou alto de hormônio somatotrópico (com sua inatividade biológica), a sensibilidade ao hormônio pode ser preservada. Não são observadas alterações na inteligência.
No nanismo genético com insensibilidade tecidual ao hormônio somatotrópico, o quadro clínico é semelhante ao da deficiência isolada do hormônio do crescimento, mas a terapia com somatotropina é ineficaz. Neste grupo, as seguintes formas principais podem ser distinguidas de acordo com o nível de IRF: com conteúdo normal (defeito no receptor de IRF) e reduzido - nanismo do tipo Laron (deficiência de IRF-1 e IRF-II) e o tipo encontrado em pigmeus africanos (deficiência de IRF-1).
O nanismo cerebral é caracterizado por doenças isoladas na família associadas a danos intrauterinos ou pós-natais no sistema nervoso central, com presença de alterações orgânicas óbvias no sistema nervoso central, frequentemente combinadas com patologia do órgão visual, presença de diabetes insípido, preservação das funções gonadotrópicas e alterações na inteligência.
Alguns tipos de disgenesia gonadal e agenesias são acompanhados por baixa estatura acentuada, em particular a síndrome de Shereshevsky-Turner e a forma "Turneroide" (em mosaico) da síndrome da disgenesia testicular. Estudos citogenéticos (cromatina sexual, cariótipo) auxiliam no diagnóstico diferencial, revelando defeitos cromossômicos, bem como defeitos característicos do desenvolvimento somático e sexual, níveis normais ou elevados de hormônio somatotrópico endógeno e insensibilidade ao tratamento com somatotropina.
Entre os distúrbios endócrinos que ocorrem com baixa estatura, destaca-se o hipotireoidismo primário, causado por hipoplasia ou aplasia congênita da glândula tireoide, sua distopia, defeitos enzimáticos na biossíntese dos hormônios tireoidianos e dano autoimune precoce à glândula tireoide. Em todas essas condições, predominam os sinais de hipotireoidismo com níveis elevados de TSH e diminuição de T4 e T3 no soro sanguíneo. No mixedema de origem autoimune, são detectados no sangue anticorpos contra tireoglobulina, frações microssomais e nucleares do tecido tireoidiano, e o nível de hormônio somatotrópico é normal ou reduzido. O efeito clínico pode ser alcançado apenas compensando o hipotireoidismo.
A baixa estatura é acompanhada por desenvolvimento sexual prematuro e síndrome adrenogenital devido ao fechamento precoce das zonas de crescimento; doença de Itsenko-Cushing, que ocorre na infância devido ao efeito inibitório dos glicocorticoides na secreção do hormônio somatotrópico e seu efeito catabólico; síndrome de Mauriac - baixa estatura e infantilismo de pacientes com diabetes mellitus insulino-dependente grave.
O nanismo hipofisário deve ser diferenciado do atraso somatogênico no desenvolvimento físico causado por distúrbios metabólicos crônicos (em doenças do fígado, rins, trato gastrointestinal), hipóxia crônica (em doenças dos sistemas cardiovascular e respiratório, na anemia); com doenças sistêmicas do sistema musculoesquelético (condrodistrofia, osteogênese imperfeita, doença da exostose), etc.
O retardo funcional (constitucional) do crescimento é por vezes observado com o início tardio da puberdade em adolescentes aparentemente saudáveis; constatamos que está principalmente associado à insuficiência transitória da atividade gonadotrópica. A secreção do hormônio somatotrópico geralmente não é prejudicada ou é ligeiramente reduzida. A estimulação das gonadotrofinas pode acelerar tanto o desenvolvimento sexual quanto o crescimento.
A baixa estatura de natureza familiar deve ser considerada como uma variante do desenvolvimento fisiológico.
O que precisa examinar?
Como examinar?
Quais testes são necessários?
Quem contactar?
Tratamento nanismo
O tratamento do nanismo é um processo longo. Isso obriga o médico a distribuir os meios para influenciar o crescimento ao longo do tempo, a fim de obter o maior efeito clínico, observando dois princípios básicos:
- aproximação máxima do desenvolvimento induzido pelo tratamento às condições fisiológicas;
- poupando as zonas de crescimento epifisário.
A longa experiência no tratamento do nanismo nos permite considerar o seguinte esquema de terapia em estágios adequado. O diagnóstico de nanismo em pacientes adultos geralmente não levanta dúvidas. Em crianças pequenas, se o quadro clínico não for claro, é necessário um período de diagnóstico: 6 a 12 meses de observação sem terapia hormonal. Durante esse período, é prescrito um tratamento geral de fortalecimento complexo; nutrição adequada com aumento do teor de proteína animal, vegetais e frutas na dieta, vitaminas A e D, suplementos de cálcio e fósforo. A ausência de alterações significativas no crescimento e no desenvolvimento físico nesse contexto e a detecção de distúrbios endócrinos durante o exame são a base para o início da terapia hormonal.
O principal tipo de terapia patogênica para nanismo hipofisário é o uso do hormônio do crescimento humano, uma vez que a ocorrência da maioria dos casos de nanismo é, sem dúvida, dependente de uma ou outra forma de sua deficiência. Devido à especificidade da espécie desse hormônio, apenas a somatotropina humana e primata é ativa para humanos. Um medicamento isolado da glândula pituitária de pessoas que morreram de doenças não infecciosas e não neoplásicas é amplamente utilizado na clínica. A somatotropina humana é obtida por síntese bacteriana usando Escherichia coli por engenharia genética. A somatotropina humana também é sintetizada quimicamente, mas é extremamente cara e praticamente não é usada na clínica. Pacientes com deficiência comprovada de hormônio do crescimento endógeno, com diferenciação esquelética não excedendo o nível típico de 13-14 anos de idade, são selecionados para tratamento com somatotropina. Não há restrições de idade para o tratamento.
As doses mínimas eficazes que podem ser utilizadas no primeiro período de tratamento são de 0,03 a 0,06 mg/kg de peso corporal. As doses mais eficazes são de 2 a 4 mg, 3 vezes por semana. O aumento da dose única para 10 mg não foi acompanhado por um aumento adequado do efeito de crescimento, mas causou rápida formação de anticorpos contra a somatotropina.
Em nosso país, o trabalho sobre o estudo do hormônio do crescimento humano vem sendo realizado desde 1960. Dois regimes de tratamento foram testados: contínuo e intermitente com cursos de 2 a 3 meses e os mesmos intervalos entre eles. O aumento médio na altura dos pacientes durante o primeiro ano de tratamento foi de 9,52 ± 0,39 cm, o aumento no peso corporal foi de 4,4 ± 0,14 kg. Com o tratamento contínuo de longo prazo, o aumento médio na altura foi de 0,82 cm / mês, peso corporal - 0,38 kg / mês; com intermitente - 0,75 cm / mês e 0,4 kg / mês, respectivamente. O tratamento contínuo proporcionou um aumento mais rápido na altura com uma diminuição acentuada no efeito após 1 a 1,5 anos, com o tratamento intermitente, a eficácia foi mantida por 3 a 4 anos, o que nos permite considerar o regime de tratamento do curso mais apropriado. A determinação do nível de IGF-I (somatomedina C) pode servir como um indicador confiável da sensibilidade do paciente ao tratamento com somatotropina. Um aumento no nível de IGF-I após a introdução do hormônio somatotrópico permite prever um efeito positivo da terapia. Uma vantagem importante do tratamento com somatotropina é a ausência de aceleração da ossificação esquelética em relação ao seu contexto.
O meio mais importante de tratar o nanismo é o uso de esteroides anabolizantes, que estimulam o crescimento aumentando a síntese proteica e o nível do hormônio somatotrópico endógeno. O tratamento é realizado por vários anos, com a substituição gradual de alguns medicamentos por outros, de compostos menos ativos para mais ativos. Uma mudança nos medicamentos anabolizantes é indicada quando o efeito do crescimento diminui após 2 a 3 anos, o que leva a um aumento adicional no crescimento. O tratamento é realizado em ciclos (o período de descanso deve ser metade do período de tratamento). Em caso de dependência, pausas mais longas também são indicadas (até 4 a 6 meses). Apenas um dos esteroides anabolizantes é prescrito por vez. A combinação de 2 ou mais medicamentos é inadequada, pois isso não aumenta seus efeitos metabólicos e de crescimento. Este último depende principalmente da idade dos pacientes e do grau de diferenciação dos ossos esqueléticos no início do tratamento. O melhor efeito é observado em pacientes com menos de 16 a 18 anos de idade com ossificação esquelética não excedendo o nível característico de um jovem de 14 anos. É aconselhável iniciar o tratamento imediatamente após o diagnóstico, geralmente entre 5 e 7 anos de idade. Antes do tratamento, é necessário evitar a prescrição de gonadotrofinas e hormônios sexuais, que, ao mesmo tempo em que estimulam o crescimento, aceleram simultaneamente a diferenciação esquelética. O princípio da dosagem de esteroides anabolizantes é a partir das doses mínimas eficazes até o aumento gradual das doses. As doses recomendadas dos medicamentos mais comuns são: nerobol (metandrostenol, dianabol) - 0,1-0,15 mg por 1 kg de peso corporal por dia, por via oral; nerobolil (durabolin) - 1 mg por 1 kg de peso corporal por mês, por via intramuscular; a dose mensal é administrada em 2-3 doses, respectivamente, após 15 ou 10 dias; retabolil (deca-durabolin) - 1 mg por 1 kg de peso corporal, uma vez por mês, por via intramuscular. Exceder as doses especificadas pode levar à androgenização. Em doses fisiológicas, esses compostos não afetam significativamente a condição dos órgãos genitais e a diferenciação dos ossos esqueléticos, o que permite seu uso prolongado em pacientes de ambos os sexos. As meninas devem estar sob a supervisão de um ginecologista, pois, em caso de overdose ou aumento da sensibilidade individual, algumas pacientes podem desenvolver sinais de virilização, que regridem rapidamente com a interrupção do tratamento. Medicamentos orais metilados a etilados na 17ª posição podem, às vezes, causar um efeito colestático; portanto, em doenças hepáticas, deve-se dar preferência a compostos anabolizantes parenterais, ou medicamentos orais devem ser combinados com agentes coleréticos. Muito raramente, o tratamento com esteroides anabolizantes pode causar reações alérgicas (coceira, erupções cutâneas). Na ausência de complicações, os esteroides anabolizantes são usados enquanto o efeito de crescimento for observado (até 16-18 anos e, às vezes, mais). O tratamento é realizado no contexto da terapia geral de fortalecimento.
Se os pacientes apresentarem sinais de hipotireoidismo, medicamentos para tireoide (tiroxina, tireoidina, thyrotom) serão prescritos simultaneamente em doses selecionadas individualmente.
No tratamento de meninos, o próximo passo é a administração de gonadotrofina coriônica humana (HGH). Este medicamento é usado não antes dos 15-16 anos, e frequentemente em idades ainda mais avançadas, para estimular as células de Leydig, o que acelera tanto o desenvolvimento sexual quanto o crescimento (devido à atividade anabólica de seus próprios andrógenos). Doses de 1.000 a 1.500 UI são usadas 1 a 2 vezes por semana, por via intramuscular, em ciclos de 2 meses, no máximo 2 a 3 vezes por ano. Se o efeito for incompleto, o tratamento com HGH em meninos com 16 anos ou mais é alternado com a administração de pequenas doses de andrógenos (metiltestosterona na dose de 5 a 10 mg/dia por via sublingual).
Meninas com mais de 16 anos podem iniciar o tratamento com pequenas doses de estrogênio, simulando um ciclo sexual normal. O tratamento é realizado durante 3 semanas de cada mês, seguido de um intervalo. Na 2ª fase do ciclo, a partir da 3ª semana, pode-se prescrever gonadotrofina coriônica na dose de 1000-1500 UI, 3 a 5 vezes por semana, ou medicamentos com efeito gestagênico (pregnin, progesterona).
A etapa final do tratamento (após o fechamento das zonas de crescimento) consiste na administração constante de doses terapêuticas de hormônios sexuais correspondentes ao sexo do paciente, a fim de desenvolver plenamente os órgãos genitais, as características sexuais secundárias e garantir a libido e a potência sexual. Preparações combinadas de estrogênio-progestogênio (Non-Ovlon, Bisecurin, Infekundin, Rigevidon) são adequadas para o tratamento de pacientes do sexo feminino, enquanto preparações de androgênio de liberação prolongada (Testenat, Sustanon-250, Omnadren-250) são adequadas para o tratamento de pacientes do sexo masculino.
É realizado um tratamento geral de fortalecimento (regime, dieta proteico-vegetal, terapia vitamínica, bioestimulantes). É indicado o uso de preparações de zinco, cujo mecanismo de ação desempenha o papel principal pelo aumento da atividade do IGF-1 (fator de crescimento semelhante à insulina I).
Na presença de patologia orgânica do sistema nervoso central, são administradas terapias anti-inflamatórias, reabsortivas e desidratantes. A terapia sistemática direcionada apresenta um efeito encorajador. Como resultado do tratamento em estágios de longo prazo, 148 (80,4%) de 175 pacientes com nanismo de ambos os sexos conseguiram atingir uma altura superior a 130 cm, 92 (52,5%) - mais de 140 cm e 32 (18,3%) - 150-160 cm ou mais. Ao mesmo tempo, 37 pacientes (21,2%) aumentaram sua altura em 30 cm, 107 (61,1%) - 31-50 cm e 31 (17,7%) - 51-60 cm ou mais.
Previsão
O prognóstico depende da forma de nanismo. Nos tipos genéticos de nanismo, o prognóstico para a vida é favorável. Na presença de tumor hipofisário e lesão orgânica do sistema nervoso central, é determinado pela dinâmica do desenvolvimento do processo patológico subjacente. Métodos modernos de terapia aumentaram significativamente as capacidades físicas e de trabalho dos pacientes, prolongando sua expectativa de vida. Durante o período de tratamento ativo, os pacientes precisam ser examinados por um médico a cada 2 a 3 meses, com terapia de manutenção a cada 6 a 12 meses.
O emprego de pacientes que corresponda às suas capacidades intelectuais e físicas é de suma importância para sua adaptação social.
É aconselhável escolher profissões que não exijam muito esforço físico, mas que permitam demonstrar habilidades intelectuais, capacidade de realizar trabalhos precisos e idiomas.


 [
[