
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Aborto espontâneo habitual - Causas
Médico especialista do artigo
Última revisão: 04.07.2025
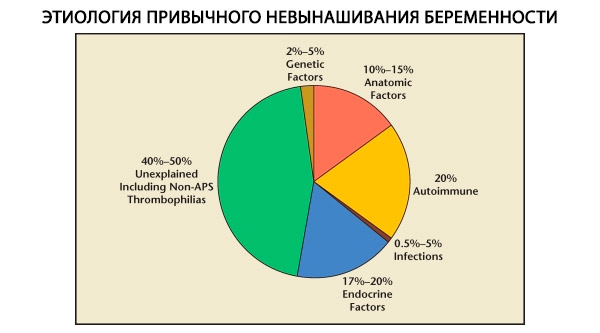
Na estrutura das perdas gestacionais habituais, distinguem-se fatores genéticos, anatômicos, endócrinos, imunológicos e infecciosos. Quando todas as causas acima são excluídas, resta um grupo de pacientes cuja origem do aborto habitual não é clara (abortos idiopáticos). Segundo C. Coulam et al. (1996), 80% dos abortos idiopáticos são baseados em distúrbios imunológicos não reconhecidos.
Não há evidências convincentes de que a endometriose cause abortos recorrentes ou que o tratamento médico ou cirúrgico da endometriose reduza a incidência de abortos recorrentes.
De acordo com os conceitos atuais, além das causas genéticas e, em parte, infecciosas que levam à formação de um embrião anormal, a implementação do efeito danoso de outros fatores (anatômicos, endócrinos, imunológicos) consiste em criar um ambiente desfavorável ao desenvolvimento de um óvulo fertilizado geneticamente completo, o que leva ao esgotamento da capacidade de reserva do córion e à interrupção do desenvolvimento (embriogênese). Os períodos críticos no primeiro trimestre da gravidez são reconhecidos como sendo de 6 a 8 semanas (morte do embrião) e de 10 a 12 semanas (expulsão do óvulo fertilizado).
 [ 1 ]
[ 1 ]
Causas genéticas do aborto espontâneo habitual
Fatores genéticos são responsáveis por 3 a 6% das causas de aborto espontâneo habitual. Em abortos esporádicos no primeiro trimestre, cerca de 50% dos abortos apresentam anormalidades cromossômicas. A maioria delas (95%) são alterações no número de cromossomos - monossomia (perda de um cromossomo), trissomia (presença de um cromossomo adicional), que são o resultado de erros na meiose, bem como poliploidia (um aumento na composição cromossômica por um conjunto haploide completo), que ocorre quando um óvulo é fertilizado por dois ou mais espermatozoides. Em abortos esporádicos, a trissomia é a mais frequentemente encontrada - 60% de todas as mutações (mais frequentemente no cromossomo 16, bem como 13, 18, 21, 22), em segundo lugar em frequência está a síndrome de Shereshevsky-Turner (cromossomo 45 X0) - 20%, os 15% restantes são explicados pela poliploidia (especialmente triploidia).
Em caso de alteração no número de cromossomos em um aborto, o exame do cariótipo dos pais na maioria das vezes não revela nenhuma patologia, e a probabilidade de uma doença cromossômica do feto durante uma gravidez subsequente é de 1%. Em contraste, ao examinar abortos em casais com abortos espontâneos habituais, alterações estruturais nos cromossomos (intra e intercromossômicos) são observadas em 3 a 6% dos casos. Ao examinar o cariótipo dos pais, rearranjos cromossômicos balanceados são encontrados em 7% dos casos. Na maioria das vezes, trata-se de translocações recíprocas, nas quais um segmento de um cromossomo é localizado no lugar de outro segmento de um cromossomo não homólogo, bem como mosaicismo de cromossomos sexuais, inversão e detecção de cromossomos em forma de anel. Na presença de tais rearranjos em um dos cônjuges, os processos de pareamento e separação dos cromossomos são prejudicados durante a meiose, o que resulta na perda (deleção) ou duplicação (duplicação) de seções cromossômicas nos gametas. Isso resulta nos chamados rearranjos cromossômicos desequilibrados, nos quais o embrião é inviável ou serve como portador de uma patologia cromossômica grave. A probabilidade de ter um filho com anormalidades cromossômicas desequilibradas na presença de rearranjos cromossômicos equilibrados no cariótipo de um dos pais é de 1 a 15%. As diferenças nos dados estão associadas à natureza dos rearranjos, ao tamanho dos segmentos envolvidos, ao sexo do portador e ao histórico familiar.
Diagnóstico
Anamnese
- Doenças hereditárias em familiares.
- Presença de anomalias congênitas na família.
- Nascimento de crianças com retardo mental.
- Presença de infertilidade e/ou aborto espontâneo de origem desconhecida em um casal ou em parentes.
- Presença de casos pouco claros de mortalidade perinatal.
Métodos especiais de pesquisa
- O estudo do cariótipo dos pais é especialmente indicado para casais no nascimento de um recém-nascido com defeitos de desenvolvimento, além de histórico de aborto espontâneo, bem como em casos de aborto habitual nos primeiros estágios da gravidez.
- Análise citogenética do aborto em casos de natimorto ou mortalidade neonatal.
Indicações para consulta com outros especialistas
Caso sejam detectadas alterações no cariótipo dos pais, é necessária uma consulta com um geneticista para avaliar o grau de risco de ter um filho com alguma patologia ou, se necessário, decidir sobre a questão da doação de um óvulo ou espermatozoide.
Gerenciamento adicional do paciente
Caso um casal apresente cariótipo patológico, mesmo em um dos pais, recomenda-se a realização de diagnóstico pré-natal durante a gestação - biópsia coriônica ou amniocentese - devido ao alto risco de distúrbios do desenvolvimento do feto.
Causas anatômicas do aborto espontâneo habitual
As causas anatômicas do aborto espontâneo habitual incluem:
- anomalias congênitas no desenvolvimento do útero (duplicação completa do útero; útero bicorno, em forma de sela, unicórnio; septo intrauterino parcial ou completo);
- defeitos anatômicos adquiridos;
- aderências intrauterinas (síndrome de Asherman);
- miomas uterinos submucosos;
- insuficiência ístmico-cervical.
A frequência de anomalias anatômicas em pacientes com aborto espontâneo habitual varia de 10 a 16%. A frequência de ocorrência de malformações uterinas que podem resultar em aborto espontâneo (mas não em infertilidade) em relação a todas as malformações uterinas é a seguinte: útero bicorno - 37%, útero em sela - 15%, septo intrauterino - 22%, duplicação completa do útero - 11%, útero unicórneo - 4,4%.
Diagnóstico de aborto espontâneo habitual
Anamnese
Em caso de patologia anatômica do útero, interrupções tardias da gravidez e partos prematuros são mais frequentemente observados; no entanto, com a implantação no septo intrauterino ou próximo ao nódulo miomatoso, interrupções precoces da gravidez também são possíveis.
Para insuficiência ístmico-cervical, o sinal patognomônico é a interrupção espontânea da gravidez no segundo trimestre ou parto prematuro precoce, que ocorre de forma relativamente rápida e com pouca dor.
Em caso de malformações do útero, é necessário prestar atenção às indicações anamnésicas de patologia do trato urinário (frequentemente acompanhando anomalias congênitas do útero) e à natureza do desenvolvimento da função menstrual (indicações de hematometra com corno rudimentar funcional do útero).
Métodos especiais de exame
- Atualmente, a histerossalpingografia é realizada para estabelecer um diagnóstico, o que permite estudar a forma da cavidade uterina, identificar a presença de miomas submucosos, aderências, septos e determinar a permeabilidade das trompas de Falópio. Para diagnosticar patologias uterinas, é racional realizar a histerossalpingografia no período entre a menstruação e a ovulação, ou seja, na primeira fase do ciclo menstrual após a cessação da secreção sanguinolenta (7º ao 9º dia do ciclo). Para diagnosticar a insuficiência ístmico-cervical, o estudo é realizado na segunda fase do ciclo menstrual (18º ao 20º dia) para determinar a condição do orifício interno do colo do útero. Antes de realizar a histerossalpingografia, é necessário excluir doenças inflamatórias dos órgãos pélvicos ou tratá-las.
- A histeroscopia se difundiu nos últimos anos e se tornou o padrão ouro para o diagnóstico de patologia intrauterina. No entanto, devido ao seu custo mais elevado em comparação com a histerossalpingografia, o método é utilizado em mulheres com indicação de patologia intrauterina com base em dados ultrassonográficos preliminares. A histeroscopia pode ser usada para examinar a cavidade uterina, determinar a natureza da patologia intrauterina e, se o equipamento necessário (ressectoscópio) estiver disponível, realizar tratamento cirúrgico minimamente invasivo – remoção de aderências, miomas submucosos e pólipos endometriais. Na remoção de um septo intrauterino, dá-se preferência à histerorressectoscopia com controle laparoscópico, que previne a possibilidade de perfuração da parede uterina.
- A ultrassonografia é realizada na primeira fase do ciclo menstrual, permitindo o diagnóstico presuntivo de mioma uterino submucoso e aderências intrauterinas, e na segunda fase do ciclo, para identificar septo intrauterino e útero bicorno. Este método é de particular importância nos estágios iniciais da gravidez, quando sua sensibilidade no diagnóstico dessas condições é de 100% e sua especificidade é de 80%. Fora da gravidez, o diagnóstico requer confirmação adicional por outros métodos.
- Autores estrangeiros apontam a vantagem da histerossonografia (ultrassonografia com sensor transvaginal com introdução prévia de solução de cloreto de sódio a 0,9% na cavidade uterina) sobre a histerossalpingografia, pois permite o diagnóstico diferencial entre o septo intrauterino e o útero bicorno. Com a histerossonografia, é possível não apenas estudar a forma da cavidade uterina, mas também determinar a configuração do fundo do corpo uterino. Em nosso país, esse método não é amplamente utilizado.
- Em alguns casos complexos, a ressonância magnética dos órgãos pélvicos é usada para verificar o diagnóstico. O método permite obter informações valiosas em caso de anomalias do desenvolvimento uterino acompanhadas por arranjo atípico de órgãos na pelve. A ressonância magnética é importante em caso de corno uterino rudimentar para decidir se é aconselhável removê-lo. A necessidade de remover o corno uterino rudimentar ocorre em caso de sua conexão com a trompa e o ovário para impedir a formação e o desenvolvimento do óvulo fertilizado nele. A interrupção da gravidez em caso de anomalias anatômicas do útero pode estar associada à implantação malsucedida do óvulo fertilizado (no septo intrauterino, próximo ao nódulo do mioma submucoso), vascularização e recepção do endométrio insuficientemente desenvolvidas, relações espaciais próximas na cavidade uterina (por exemplo, em caso de deformação da cavidade por um nódulo do mioma), frequentemente acompanhada de ICI e distúrbios hormonais.
Tratamento do aborto espontâneo habitual
Tratamento cirúrgico
Na presença de septo intrauterino, linfonodos submucosos de mioma e aderências, o tratamento cirúrgico mais eficaz é a histerorresectoscopia. A frequência de abortos subsequentes nesse grupo de mulheres após o tratamento é de 10%, em comparação com 90% antes da cirurgia. Ao comparar os resultados da metroplastia realizada por laparotomia e da histerorresectoscopia transcervical, P. Heinonen (1997) obteve resultados que indicaram menor trauma e maior eficácia da histerorresectoscopia; a porcentagem de gestações que resultaram no nascimento de crianças viáveis foi de 68% e 86%, respectivamente.
A remoção cirúrgica do septo intrauterino, aderências e linfonodos submucosos do mioma elimina o aborto espontâneo em 70 a 80% dos casos. No entanto, é ineficaz em mulheres com malformações uterinas que tiveram partos normais com abortos recorrentes subsequentes. É provável que, nesses casos, o fator anatômico não seja a causa principal, sendo necessário procurar outras causas de aborto espontâneo.
Está comprovado que a metroplastia abdominal está associada a um risco significativo de infertilidade pós-operatória e não melhora o prognóstico de gestações subsequentes. Portanto, é preferível dar preferência à histeroscopia e às cirurgias laparoscópicas.
Tratamento medicamentoso
A eficácia da introdução do DIU, de altas doses de medicamentos estrogênicos, da introdução de um cateter de Foley na cavidade uterina após operações para remover aderências e do septo intrauterino não foi comprovada. Recomenda-se planejar a gravidez não antes de 3 meses após a operação. Para melhorar o crescimento do endométrio, a terapia hormonal cíclica é realizada durante 3 ciclos menstruais [14]. Durante 3 meses, nos primeiros 14 dias do ciclo, é aconselhável tomar um medicamento contendo 2 mg de 17-beta-estradiol, nos 14 dias seguintes - 2 mg de 17-beta-estradiol e 20 mg de didrogesterona (10 mg de didrogesterona como parte de um medicamento combinado mais 10 mg de didrogesterona em um comprimido separado).
Gerenciamento adicional do paciente
Características do curso da gravidez com útero bicorno ou duplicação do útero (quando há 2 cavidades uterinas):
- nos primeiros estágios da gravidez, o sangramento geralmente ocorre do corno "vazio" ou da cavidade uterina devido a uma reação decidual pronunciada; as táticas neste caso devem ser conservadoras e consistir no uso de agentes antiespasmódicos e hemostáticos;
- ameaça de interrupção da gravidez em várias fases;
- desenvolvimento de insuficiência ístmico-cervical;
- retardo de crescimento intrauterino devido à insuficiência placentária.
Nos primeiros estágios da gravidez, em caso de sangramento, é aconselhável repouso no leito e semi-leito, bem como a administração de medicamentos hemostáticos, antiespasmódicos e sedativos, e terapia com gestagênios (didrogesterona na dose diária de 20 a 40 mg) até 16–18 semanas de gestação.
Causas endócrinas do aborto espontâneo habitual
Segundo diversos autores, as causas endócrinas do aborto espontâneo representam de 8 a 20%. As mais significativas são a deficiência da fase lútea (DFL), a hipersecreção de LH, a disfunção tireoidiana e o diabetes mellitus.
Doenças graves da tireoide ou diabetes mellitus podem levar a abortos espontâneos recorrentes. No entanto, no diabetes mellitus compensado, o risco de abortos espontâneos recorrentes não difere daquele na população em geral.
Ao mesmo tempo, a alta incidência de hipotireoidismo na população requer triagem com dosagem de TSH. Em pacientes com aborto espontâneo habitual, a insuficiência da fase lútea é observada em 20 a 60% dos casos, e sinais ultrassonográficos de ovários policísticos - em 44 a 56%. De acordo com a literatura, a influência de distúrbios hormonais individuais na formação do complexo de sintomas do aborto espontâneo habitual permanece controversa. Os estudos de M. Ogasawara et al. (1997) não revelaram diferenças significativas na frequência de interrupção da gravidez com e sem LPI em pacientes com dois ou mais abortos espontâneos anteriores na anamnese, excluindo causas autoimunes, anatômicas e infecciosas.
A insuficiência da função do corpo lúteo pode ser resultado de uma série de fatores desfavoráveis:
- distúrbios na secreção de FSH e LH na primeira fase do ciclo menstrual;
- pico precoce ou, inversamente, muito tardio de liberação de LH;
- hipoestrogenismo como consequência de foliculogênese inadequada. Todas essas condições não estão sujeitas à correção por terapia de reposição com fármacos gestagênicos no período pós-ovulatório. Estudos prospectivos conduzidos por L. Regan et al. mostraram um aumento significativo na frequência de abortos espontâneos em pacientes com hipersecreção de LH no 8º dia do ciclo menstrual em comparação com mulheres com níveis sanguíneos normais de LH (65% e 12% de abortos espontâneos, respectivamente). O efeito prejudicial de um pico prematuro de LH está associado à retomada prematura da segunda divisão meiótica e à ovulação de um óvulo imaturo, bem como à indução da produção de andrógenos pelas células da teca, juntamente com a recepção endometrial prejudicada sob a influência da insuficiência gestagênica. No entanto, a redução preliminar dos níveis pré-ovulatórios de LH com agonistas do hormônio liberador de gonadotrofinas, sem medidas adicionais destinadas a prolongar a gravidez subsequente, não proporciona a redução esperada na frequência de abortos espontâneos.
O padrão ouro para o diagnóstico de NLF é o exame histológico do material obtido da biópsia endometrial na segunda fase do ciclo ao longo de 2 ciclos menstruais.
O diagnóstico de outras causas de disfunção ovulatória, como hiperprolactinemia, hipotireoidismo, excesso funcional de andrógenos (ovarianos ou adrenais), deve ser acompanhado da prescrição de tratamento adequado.
Diagnóstico
História e exame físico
- Histórico. Fatores a serem considerados: menarca tardia, ciclo menstrual irregular (oligomenorreia, amenorreia, ganho de peso repentino, perda de peso, infertilidade, abortos espontâneos precoces habituais).
- Exame: tipo corporal, altura, peso corporal, hirsutismo, gravidade das características sexuais secundárias, presença de estrias, exame das glândulas mamárias para galactorreia.
- Testes diagnósticos funcionais: medição da temperatura retal durante 3 ciclos menstruais.
Métodos especiais de pesquisa
- Estudo hormonal:
- na 1ª fase do ciclo menstrual (7º–8º dia) – determinação do conteúdo de FSH, LH, prolactina, TSH, testosterona, 17-hidroxiprogesterona (17-OP), DHEAS;
- na 2ª fase do ciclo menstrual (21–22 dias) – determinação do conteúdo de progesterona (os indicadores normativos dos níveis de progesterona são muito variáveis, o método não pode ser usado sem levar em consideração outros fatores).
- Ultrassom:
- na 1ª fase do ciclo menstrual (5º–7º dia) – diagnóstico de patologia endometrial, ovários policísticos;
- na 2ª fase do ciclo menstrual (20–21 dias) – medição da espessura do endométrio (normal 10–11 mm, correlaciona-se com o conteúdo de progesterona).
- Uma biópsia endometrial para verificar a FNL é realizada 2 dias antes da menstruação esperada (no 26º dia em um ciclo de 28 dias). Este método é utilizado em casos em que o diagnóstico não é claro. Para estudar as alterações no endométrio no período chamado de "janela de implantação", uma biópsia é realizada no 6º dia após a ovulação.
Tratamento
Ao diagnosticar NLF (de acordo com gráficos de temperatura retal, a duração da 2ª fase é inferior a 11 dias, um aumento gradual na temperatura é observado, transformação secretora insuficiente do endométrio de acordo com dados de biópsia endometrial, baixos níveis de progesterona no soro sanguíneo), é necessário identificar a causa de tais distúrbios.
Se a LNF for acompanhada de hiperprolactinemia, é realizada uma ressonância magnética do cérebro. Um método alternativo é a radiografia do crânio (região da sela túrcica).
O primeiro passo na hiperprolactinemia é excluir adenoma hipofisário, que requer tratamento cirúrgico. Na ausência de alterações significativas, a hiperprolactinemia é considerada funcional, e o tratamento com bromocriptina é prescrito para normalizar os níveis de prolactina. A dose inicial de bromocriptina é de 1,25 mg/dia por 2 semanas. Após o monitoramento dos níveis de prolactina, se os indicadores não normalizarem, a dose é aumentada para 2,5 mg/dia. Com um aumento significativo nos níveis de prolactina, a dose inicial é de 2,5 mg/dia. Em caso de gravidez, a bromocriptina deve ser descontinuada.
Se for detectado hipotireoidismo, a natureza da patologia tireoidiana é determinada em conjunto com um endocrinologista. Em qualquer caso, a terapia diária com levotiroxina sódica é indicada, sendo a dose selecionada individualmente até a normalização dos níveis de TSH. Em caso de gravidez, o tratamento com levotiroxina sódica deve ser continuado. A questão da conveniência de aumentar a dose no primeiro trimestre da gravidez é decidida em conjunto com um endocrinologista após a obtenção dos resultados de um exame hormonal (nível de TSH, tiroxina livre).
A correção da FNL é realizada de duas maneiras: a primeira é a estimulação da ovulação e a segunda é a terapia de reposição com preparações de progesterona.
A primeira opção de tratamento é a estimulação da ovulação com citrato de clomifeno. Este método de tratamento baseia-se no fato de que a maioria dos distúrbios da fase lútea se origina na fase folicular do ciclo. Níveis constantemente reduzidos de progesterona na segunda fase são consequência da foliculogênese prejudicada na primeira fase do ciclo. Esse distúrbio será corrigido com maior sucesso com baixas doses de citrato de clomifeno na fase folicular inicial do que com a prescrição de progesterona na segunda fase do ciclo.
No 1º ciclo, a dose de citrato de clomifeno é de 50 mg/dia, do 5º ao 9º dia do ciclo menstrual. A eficácia é monitorada por meio de gráficos de temperatura retal, medições dos níveis de progesterona na 2ª fase do ciclo ou ultrassom dinâmico. Se não houver efeito suficiente no 2º ciclo de estimulação da ovulação, a dose de citrato de clomifeno deve ser aumentada para 100 mg/dia, do 5º ao 9º dia do ciclo. A dose máxima possível no 3º ciclo de estimulação da ovulação é de 150 mg/dia. Esse aumento na dose só é possível se o medicamento for bem tolerado (sem dor intensa na região inferior do abdômen e na região lombar e sem outros sinais de hiperestimulação ovariana).
A segunda opção de tratamento é a terapia de reposição com preparações de progesterona, que promovem a transformação secretora completa do endométrio, o que proporciona o efeito necessário em pacientes com aborto espontâneo habitual com ovulação preservada. Além disso, nos últimos anos, verificou-se que a administração de preparações de progesterona tem não apenas um efeito hormonal, mas também imunomodulador, suprimindo as reações de rejeição das células imunocompetentes do endométrio. Em particular, um efeito semelhante foi descrito para a di-hidrogesterona na dose de 20 mg/dia. Para fins de terapia de reposição, utiliza-se didrogesterona na dose de 20 mg/dia por via oral ou progesterona micronizada por via vaginal na dose de 200 mg/dia. O tratamento é realizado no 2º dia após a ovulação (no dia seguinte ao aumento da temperatura retal) e continua por 10 dias. Se ocorrer gravidez, o tratamento com preparações de progesterona deve ser continuado.
Pesquisas modernas não confirmaram a eficácia da gonadotrofina coriônica humana no tratamento de aborto espontâneo recorrente.
No hiperandrogenismo (gênese ovariana ou adrenal) em pacientes com aborto espontâneo habitual, o tratamento medicamentoso é indicado devido ao efeito dos andrógenos na integralidade da ovulação e no estado do endométrio. Em caso de violação da biossíntese de andrógenos adrenais, seu efeito virilizante no feto feminino é possível, portanto, a terapia com esteroides é realizada no interesse do feto.
Hiperandrogenismo da gênese ovariana (ovários policísticos)
Histórico, exame físico e resultados de exames especiais
- Histórico: menarca tardia, distúrbios do ciclo menstrual, como oligomenorreia (geralmente primária, menos frequentemente secundária). Gestações são raras, geralmente interrompidas espontaneamente no primeiro trimestre, com longos períodos de infertilidade entre as gestações.
- Exame: hirsutismo, acne, estrias, alto índice de massa corporal (opcional).
- Gráficos de temperatura retal: ciclos anovulatórios alternam com ciclos com ovulação e NLF.
- Exame hormonal: níveis elevados de testosterona, níveis de FSH e LH podem estar elevados, relação LH/FSH maior que 3. Ultrassonografia: ovários policísticos.
Tratamento
Tratamento não medicamentoso
Perda de peso - dietoterapia, atividade física.
Tratamento medicamentoso
- Orlistate na dose de 120 mg com cada refeição principal. A duração do tratamento é determinada levando em consideração o efeito e a tolerabilidade.
- Redução preliminar de testosterona com preparações contendo acetato de ciproterona (2 mg) e EE (35 mcg) durante 3 ciclos menstruais.
- Suspensão do contraceptivo, suporte hormonal da segunda fase do ciclo (terapia com gestagênio) - didrogesterona na dose de 20 mg/dia do 16º ao 25º dia do ciclo menstrual. Se não houver ovulação espontânea, prossiga para a próxima fase.
- Estimulação da ovulação com citrato de clomifeno na dose inicial de 50 mg/dia do 5º ao 9º dia do ciclo menstrual com terapia simultânea com gestagênios (didrogesterona na dose de 20 mg/dia do 16º ao 25º dia do ciclo) e dexametasona (0,5 mg).
- Na ausência de gravidez, a dose de citrato de clomifeno é aumentada para 100-150 mg/dia com a administração de gestagênios na segunda fase do ciclo e dexametasona (0,5 mg). Foi estabelecido que, embora a dexametasona reduza apenas os níveis de andrógenos adrenais, a ovulação e a concepção ocorrem significativamente mais frequentemente com o tratamento com citrato de clomifeno e dexametasona do que com o uso isolado de citrato de clomifeno [12].
- São realizados três ciclos de estimulação da ovulação, após os quais se recomenda uma pausa de três ciclos menstruais com suporte gestagênico e a decisão pelo tratamento cirúrgico por via laparoscópica (ressecção em cunha dos ovários, vaporização a laser).
Gerenciamento adicional do paciente
O manejo da gravidez deve ser acompanhado de suporte gestagênico até a 16ª semana de gestação (didrogesterona na dose de 20 mg/dia ou progesterona micronizada na dose de 200 mg/dia). A dexametasona é prescrita apenas no primeiro trimestre da gestação. O monitoramento é obrigatório para o diagnóstico oportuno da insuficiência ístmico-cervical e, se necessário, sua correção cirúrgica.
Hiperandrogenismo adrenal (síndrome adrenogenital puberal e pós-puberal)
A síndrome adrenogenital (SAG) é uma doença hereditária associada a uma interrupção na síntese de hormônios do córtex adrenal devido a danos em genes responsáveis pela síntese de diversos sistemas enzimáticos. A doença é herdada de forma autossômica recessiva, com a transmissão de genes mutantes de ambos os pais, portadores saudáveis.
Em 90% dos casos, a síndrome adrenogenital é causada por mutações no gene CYP21B, levando a uma interrupção na síntese da 21-hidroxilase.
Histórico, exame físico e resultados de exames especiais
- Histórico: menarca tardia, ciclo menstrual ligeiramente prolongado, possível oligomenorreia, abortos espontâneos no primeiro trimestre, possível infertilidade.
- Exame: acne, hirsutismo, tipo de corpo andróide (ombros largos, pélvis estreita), hipertrofia do clitóris.
- Gráficos de temperatura retal: ciclos anovulatórios alternam com ciclos com ovulação e NLF.
- Teste hormonal: níveis elevados de 17-OP, DHEAS.
- Ultrassom: ovários sem alterações.
Um sinal patognomônico fora da gravidez é um aumento na concentração de 17-OP no plasma sanguíneo.
Atualmente, um teste com ACTH é usado para diagnosticar a forma latente e não clássica do hiperandrogenismo adrenal. Para esse teste, utiliza-se o Synacthen, um polipeptídeo sintético que possui as propriedades do ACTH endógeno, ou seja, estimula as fases iniciais da síntese de hormônios esteroides a partir do colesterol nas glândulas suprarrenais.
Teste de Synacthen (um análogo do ACTH): 1 ml (0,5 mg) de Synacthen é injetado subcutaneamente no ombro. O conteúdo inicial de 17-OP e cortisol é determinado inicialmente na amostra de plasma sanguíneo coletada pela manhã, após 9 horas. Uma amostra de sangue de controle é coletada 9 horas após a injeção para determinar os níveis de 17-OP e cortisol. O índice de determinação (D) é então calculado usando a fórmula:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP - 0,018 × Cortisol/17-OP
Se o coeficiente D for menor ou igual a 0,069, isso indica ausência de hiperandrogenismo adrenal. Se o coeficiente D for maior que 0,069, deve-se considerar que o hiperandrogenismo é causado por uma disfunção das glândulas suprarrenais.
Tratamento medicamentoso
A base do tratamento para hiperandrogenismo devido à deficiência de 21-hidroxilase são os glicocorticoides, que são usados para suprimir o excesso de secreção de andrógenos.
Gerenciamento adicional do paciente
Devido ao efeito virilizante dos andrógenos maternos sobre o feto, com diagnóstico estabelecido de hiperandrogenismo adrenal, o tratamento com dexametasona na dose inicial de 0,25 mg é prescrito antes da gravidez e continuado em uma dose selecionada individualmente (de 0,5 a 1 mg) durante toda a gestação. Em mulheres com aborto espontâneo recorrente e hiperandrogenismo adrenal, não é apropriado interromper o tratamento, visto que a frequência de abortos espontâneos na ausência de tratamento chega a 14%, com continuação - 9%.
Considerando que pacientes com síndrome adrenogenital podem transmitir esse gene ao feto, é necessário realizar o diagnóstico pré-natal: entre 17 e 18 semanas de gestação, é prescrito um exame de sangue para determinar o conteúdo de 17-OP na mãe. Se o nível do hormônio no sangue estiver elevado, sua concentração no líquido amniótico é determinada. Se o conteúdo de 17-OP no líquido amniótico estiver elevado, a síndrome adrenogenital no feto é diagnosticada. Infelizmente, é impossível determinar a gravidade da síndrome adrenogenital (forma leve ou grave com perda de sal) pelo nível de 17-OP no líquido amniótico. A questão de manter a gravidez nessa situação é decidida pelos pais.
Se o pai da criança for portador do gene da síndrome adrenogenital e houver casos de crianças nascidas com essa síndrome na família, a paciente, mesmo sem hiperandrogenismo adrenal, receberá dexametasona para o bem do feto (para prevenir a virilização do feto feminino) na dose de 20 mcg/kg de peso corporal, com no máximo 1,5 mg/dia em 2 a 3 doses após as refeições. Às 17-18 semanas, após a determinação do sexo do feto e da expressão do gene da síndrome adrenogenital (com base nos resultados da amniocentese), o tratamento é continuado até o final da gestação se o feto for uma menina com síndrome adrenogenital. Se o feto for um menino ou uma menina que não seja portador do gene da síndrome adrenogenital, a dexametasona pode ser descontinuada.
Se uma mulher com aborto espontâneo habitual sofre de hiperandrogenismo adrenal, o tratamento com dexametasona é realizado durante toda a gravidez e interrompido somente após o parto. No 3º dia após o parto, a dose de dexametasona é reduzida gradualmente (em 0,125 mg a cada 3 dias) até a interrupção completa no período pós-parto.
Hiperandrogenismo de gênese mista (ovariano e adrenal)
Histórico, exame físico e resultados de exames especiais
- Histórico: menarca tardia, distúrbios do ciclo menstrual, como oligomenorreia (geralmente primária, menos frequentemente secundária), amenorreia, possíveis lesões, concussões. Gestações são raras, geralmente interrompidas espontaneamente no primeiro trimestre, com longos períodos de infertilidade entre as gestações.
- Exame físico: hirsutismo, acne, estrias, acantose nigricans, alto índice de massa corporal, hipertensão.
- Gráficos de temperatura retal: ciclos anovulatórios alternam com ciclos com ovulação e NLF.
- Exame hormonal: níveis elevados de testosterona, níveis de FSH e LH podem estar elevados, relação LH/FSH maior que 3, níveis elevados de DHEAS, 17-OP, hiperprolactinemia pode estar presente.
- Ultrassom: ovários policísticos.
- Eletroencefalografia: alterações na atividade bioelétrica do cérebro.
- Hiperinsulinemia, distúrbio do metabolismo lipídico (colesterol alto, lipoproteínas de baixa densidade e lipoproteínas de muito baixa densidade), diminuição da tolerância à glicose ou níveis elevados de glicose no sangue.
Tratamento
Tratamento não medicamentoso
Perda de peso (dieta hipocalórica, atividade física).
Tratamento medicamentoso
Primeira etapa - na presença de resistência à insulina, recomenda-se prescrever metformina na dose diária de 1000-1500 mg para aumentar a sensibilidade à insulina.
Segunda etapa - em caso de distúrbios graves do ciclo menstrual e níveis elevados de testosterona, recomenda-se prescrever medicamentos com efeito antiandrogênico contendo acetato de ciproterona (2 mg) e etinilestradiol (35 mcg) por 3 meses.
A terceira etapa é a estimulação da ovulação seguida de suporte gestagênico (o esquema é descrito acima) e administração de dexametasona na dose diária de 0,25–0,5 mg.
Em caso de hiperprolactinemia e hipotireoidismo, deve-se realizar a correção medicamentosa adequada nos ciclos de estimulação da ovulação. Em caso de gravidez, a bromocriptina deve ser descontinuada e a levotiroxina deve ser continuada.
Se a estimulação da ovulação for ineficaz, deve-se decidir sobre a prescrição de indutores diretos da ovulação, a conveniência do tratamento cirúrgico dos ovários policísticos ou a fertilização in vitro.
Gerenciamento adicional do paciente
Em pacientes com síndrome metabólica, a gravidez é frequentemente complicada por hipertensão arterial, nefropatia e hipercoagulabilidade, sendo necessário monitorar a pressão arterial e realizar hemostasiogramas desde o início da gravidez e corrigir os distúrbios emergentes (se necessário) com anti-hipertensivos, antiplaquetários e anticoagulantes. Medicamentos gestagênicos são prescritos até a 16ª semana de gestação - didrogesterona na dose de 20 mg/dia ou progesterona micronizada na dose de 200 mg/dia em 2 doses.
Todas as mulheres com hiperandrogenismo representam um grupo de risco para o desenvolvimento de insuficiência ístmico-cervical. O monitoramento da condição do colo do útero deve ser realizado a partir da 16ª semana de gestação e, se necessário, a correção cirúrgica da insuficiência ístmico-cervical.
Causas imunológicas do aborto espontâneo habitual
Sabe-se atualmente que cerca de 80% de todos os casos previamente inexplicáveis de abortos recorrentes (após a exclusão de causas genéticas, anatômicas e hormonais) estão associados a distúrbios imunológicos. Distinguem-se entre distúrbios autoimunes e aloimunes, que levam ao aborto espontâneo habitual.
Em processos autoimunes, os próprios tecidos do sistema imunológico tornam-se alvo de agressão, ou seja, a resposta imune é direcionada contra seus próprios antígenos. Nessa situação, o feto sofre secundariamente em decorrência dos danos aos tecidos da mãe.
Em distúrbios aloimunes, a resposta imunológica da mulher é direcionada contra antígenos embrionários/fetais recebidos do pai e que são potencialmente estranhos ao corpo da mãe.
As doenças autoimunes mais frequentemente encontradas em pacientes com aborto espontâneo habitual incluem a presença de autoanticorpos antifosfolipídeos, antitireoidianos e antinucleares no soro. Assim, foi estabelecido que 31% das mulheres com aborto espontâneo habitual fora da gravidez apresentam autoanticorpos contra tireoglobulina e peroxidase tireoidiana (autoanticorpos microssomais da tireoide [peroxidase tireoidiana]); nesses casos, o risco de aborto espontâneo no primeiro trimestre da gravidez aumenta para 20%. No aborto espontâneo habitual, a presença de anticorpos antinucleares e antitireoidianos indica a necessidade de exames complementares para identificar o processo autoimune e confirmar o diagnóstico.
A síndrome do anticorpo antifosfolipídeo (SAF) continua sendo uma condição autoimune geralmente reconhecida que leva à morte embrionária/fetal.
Distúrbios aloimunes
Atualmente, os processos aloimunes que levam à rejeição fetal incluem a presença de um número aumentado (mais de 3) de antígenos comuns do sistema do complexo principal de histocompatibilidade em cônjuges (frequentemente observado em casamentos consanguíneos); baixos níveis de fatores de bloqueio no soro da mãe; níveis aumentados de células assassinas naturais (células NK CD56, CD16) no endométrio e no sangue periférico da mãe, tanto fora da gravidez quanto durante a gravidez; altos níveis de concentração de várias citocinas no endométrio e no soro sanguíneo, em particular, γ-interferon, fator de necrose tumoral a, interleucinas-1 e 2.
Atualmente, estão em estudo os fatores aloimunes que levam a perdas gestacionais precoces e as formas de corrigi-las. Não há consenso sobre os métodos de tratamento. Segundo alguns pesquisadores, a imunização ativa com linfócitos de doadores não produz um efeito significativo, enquanto outros autores descrevem um efeito positivo significativo com essa imunização e o tratamento com imunoglobulinas.
Atualmente, um dos agentes imunomoduladores no início da gravidez é a progesterona. Em particular, estudos comprovaram o papel da didrogesterona na dose diária de 20 mg em mulheres com aborto espontâneo habitual no primeiro trimestre da gravidez com níveis elevados de células CD56 no endométrio.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Trombofilias geneticamente determinadas
As seguintes formas de trombofilias geneticamente determinadas são consideradas condições trombofílicas durante a gravidez, levando ao aborto espontâneo habitual.
- Deficiência de antitrombina III.
- Mutação do fator V (mutação de Leiden).
- Deficiência de proteína C.
- Deficiência de proteína S.
- Mutação do gene da protrombina G20210A.
- Hiper-homocisteinemia.
O exame para identificar causas raras de trombofilia é necessário nos casos em que houve:
- histórico familiar - tromboembolismo antes dos 40 anos em parentes;
- episódios confiáveis de trombose venosa e/ou arterial antes dos 40 anos;
- trombose recorrente no paciente e familiares imediatos;
- complicações tromboembólicas durante a gravidez e após o parto ao usar contraceptivos hormonais;
- perdas repetidas de gravidez, natimortos, retardo de crescimento intrauterino, descolamento prematuro da placenta;
- pré-eclâmpsia de início precoce, síndrome HELLP.
Causas infecciosas de aborto espontâneo habitual
O papel do fator infeccioso como causa de aborto espontâneo habitual é atualmente amplamente debatido. Sabe-se que a infecção primária nos estágios iniciais da gravidez pode causar danos ao embrião incompatíveis com a vida, o que leva a abortos espontâneos esporádicos. No entanto, a probabilidade de reativação da infecção concomitante a perdas gestacionais repetidas é insignificante. Além disso, microrganismos que provocam abortos espontâneos habituais não foram encontrados até o momento. Estudos nos últimos anos mostraram que a maioria das mulheres com aborto espontâneo habitual e endometrite crônica apresenta uma prevalência de 2 a 3 ou mais tipos de microrganismos anaeróbicos obrigatórios e vírus no endométrio.
De acordo com VM Sidelnikova et al., em mulheres que sofreram aborto espontâneo habitual, o diagnóstico de endometrite crônica fora da gravidez foi histologicamente verificado em 73,1% dos casos e em 86,7%, foi observada persistência de microrganismos oportunistas no endométrio, o que certamente pode ser a causa da ativação de processos imunopatológicos. Infecção viral persistente mista (vírus herpes simplex, Coxsackie A, Coxsackie B, enterovírus 68-71, citomegalovírus) é encontrada em pacientes com aborto espontâneo habitual significativamente mais frequentemente do que em mulheres com histórico obstétrico normal. K. Kohut et al. (1997) mostraram que a porcentagem de alterações inflamatórias no endométrio e tecido decidual em pacientes com aborto espontâneo recorrente primário é significativamente maior do que em mulheres após aborto espontâneo com histórico de pelo menos um parto a termo.
A colonização bacteriana e viral do endométrio geralmente resulta da incapacidade do sistema imunológico e de forças protetoras inespecíficas do corpo (sistema complemento, fagocitose) de eliminar completamente o agente infeccioso e, ao mesmo tempo, sua disseminação é limitada pela ativação de linfócitos T (T-helpers, células T-killers) e macrófagos. Em todos os casos acima, ocorre persistência de microrganismos, caracterizada pela atração de fagócitos mononucleares, células T-killers, células T-helpers, que sintetizam diversas citocinas, para o local da inflamação crônica. Aparentemente, esse estado do endométrio impede a criação de imunossupressão local no período pré-implantação, necessária para formar uma barreira protetora e prevenir a rejeição de um feto semi-estranho.
Nesse sentido, antes da gravidez, mulheres com abortos espontâneos recorrentes devem ser diagnosticadas com endometrite crônica. Para estabelecer ou descartar esse diagnóstico, é realizada uma biópsia endometrial no 7º ou 8º dia do ciclo menstrual, com exame histológico, PCR e exame bacteriológico do material da cavidade uterina. Após a confirmação do diagnóstico, a endometrite crônica é tratada de acordo com os padrões para o tratamento de doenças inflamatórias dos órgãos pélvicos.

