
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Vírus da imunodeficiência humana (VIH)
Médico especialista do artigo
Última revisão: 04.07.2025
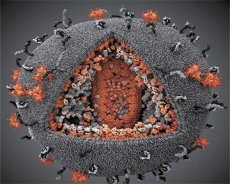
A Síndrome da Imunodeficiência Adquirida foi identificada como uma doença específica em 1981 nos Estados Unidos, quando vários jovens desenvolveram doenças graves causadas por microrganismos não patogênicos ou fracamente patogênicos para pessoas saudáveis. Um estudo do estado imunológico dos pacientes revelou uma diminuição acentuada no número de linfócitos em geral e de células T auxiliares em particular. Essa condição foi chamada de AIDS (Síndrome da Imunodeficiência Adquirida). O método de infecção (contato sexual, através do sangue e suas preparações) indicou a natureza infecciosa da doença.
O agente causador da AIDS foi descoberto em 1983 de forma independente pelo francês L. Montagnier, que o denominou Vírus Associado à Linfoadenopatia LAV, pois o encontrou em um paciente com linfadenopatia; e pelo americano R. Gallo, que denominou o vírus de HTLV-III (Vírus Linfotrópico T Humano III): ele já havia descoberto os vírus linfotrópicos I e II.
Uma comparação das propriedades dos vírus LAV e HTLV-III mostrou sua identidade, então, para evitar confusão, o vírus foi denominado HIV (Vírus da Imunodeficiência Humana, ou HIV) em 1986. O HIV tem formato esférico, com diâmetro de 110 nm. O envelope do vírus tem o formato de um poliedro, composto por 12 pentágonos e 20 hexágonos. No centro e nos cantos de cada hexágono está uma molécula da proteína glicosilada gpl20 (o número 120 indica o peso molecular da proteína em quilodaltons). Um total de 72 moléculas de gpl20 estão localizadas na superfície do vírion na forma de espículas peculiares, cada uma das quais está associada à proteína intramembrana gp41. Essas proteínas, juntamente com a dupla camada lipídica, formam o supercapsídeo (membrana) do vírion.
As proteínas gpl20 e gp41 são formadas pelo corte da proteína precursora Env por uma protease celular. A proteína gp41 forma a "haste" da espícula ligando-se, com seu domínio citoplasmático, à proteína da matriz p17MA localizada diretamente abaixo do envelope. As moléculas p17 interagem durante a maturação do vírion para formar um icosaedro subjacente ao envelope.
Na parte central do vírion, a proteína p24 forma um capsídeo em forma de cone. A parte mais estreita do capsídeo está conectada à membrana do vírion com a participação da proteína rb. Dentro do capsídeo, existem duas moléculas idênticas de RNA genômico viral. Elas estão conectadas por suas extremidades 5' à proteína p7NC do nucleocapsídeo. Essa proteína é interessante porque possui dois resíduos de aminoácidos (motivos) ricos em cisteína e histidina e contendo um átomo de Zn – são chamados de "dedos de zinco" porque capturam moléculas de RNA genômico para inclusão nos vírions em formação. O capsídeo também contém três enzimas. A revertase (RT), ou complexo pol, inclui a transcriptase reversa, a RNase H e a DNA polimerase dependente de DNA. A revertase está presente como um heterodímero p66/p51. A protease (PR) – p10 – inicia e implementa o processo de maturação do vírion. A integrase (IN) - p31, ou endonuclease, garante a inclusão do DNA proviral no genoma da célula hospedeira. O capsídeo também contém uma molécula de RNA primer (tRNAl"3).
O genoma de RNA na célula é convertido em um genoma de DNA (DNA provírus) com a ajuda da transcriptase reversa, consistindo em 9.283 pares de nucleotídeos. Ele é delimitado à esquerda e à direita pelas chamadas repetições terminais longas, ou LTRs: S'-LTR à esquerda e 3'-LTR à direita. As LTRs contêm 638 pares de nucleotídeos cada.
O genoma do HIV é composto por 9 genes, alguns dos quais se sobrepõem nas extremidades (possuem vários quadros de leitura) e possuem uma estrutura de exonintron. Eles controlam a síntese de 9 proteínas estruturais e 6 regulatórias.
A importância dos LTRs para o genoma viral é que eles contêm os seguintes elementos reguladores que controlam seu funcionamento:
- sinal de transcrição (região promotora);
- sinal de adição poli-A;
- sinal de limitação;
- sinal de integração;
- sinal de regulação positiva (TAR para proteína TAT);
- elemento regulador negativo (NRE para proteína NEF);
- um local para ligação do RNA primer (tRNA™3) para síntese de DNA de fita negativa na extremidade 3'; um sinal na extremidade 5' do LTR que serve como um primer para síntese de DNA de fita positiva.
Além disso, a LTR contém elementos envolvidos na regulação do splicing do mRNA, o empacotamento de moléculas de vRNA no capsídeo (elemento Psi). Por fim, durante a transcrição do genoma, dois sinais são formados em mRNAs longos para a proteína REV, que alternam a síntese proteica: CAR - para proteínas reguladoras e CRS - para proteínas estruturais. Se a proteína REV se liga ao CAR, proteínas estruturais são sintetizadas; se ele estiver ausente, apenas proteínas reguladoras são sintetizadas.
Os seguintes genes reguladores e suas proteínas desempenham um papel particularmente importante na regulação do funcionamento do genoma do vírus:
- Proteína TAT, que realiza o controle positivo da replicação viral e atua por meio da região reguladora TAR;
- Proteínas NEV e VPU, que exercem controle negativo da replicação através da região NRE;
- Proteína REV, que realiza o controle positivo-negativo. A proteína REV controla o funcionamento dos genes gag, pol e env e realiza a regulação negativa do splicing.
Assim, a replicação do HIV está sob triplo controle: positivo, negativo e positivo-negativo.
A proteína VIF determina a infectividade do vírus recém-sintetizado. Ela está associada à proteína do capsídeo p24 e está presente no vírion na quantidade de 60 moléculas. A proteína NEF é representada no vírion por um pequeno número de moléculas (5 a 10), possivelmente associadas ao envelope.
A proteína VPR inibe o ciclo celular na fase G2, participa do transporte de complexos de pré-integração para o núcleo da célula, ativa alguns genes virais e celulares e aumenta a eficiência da replicação viral em monócitos e macrófagos. A localização das proteínas VPR, TAT, REV e VPU no vírion não foi estabelecida.
Além de suas próprias proteínas, a membrana do vírion pode conter algumas proteínas da célula hospedeira. As proteínas VPU e VPR participam da regulação da reprodução viral.
Variantes antigênicas do vírus da imunodeficiência humana (HIV)
O vírus da imunodeficiência humana (HIV) é muito variável. Mesmo a partir do corpo de um paciente, podem ser isoladas cepas virais que diferem significativamente em propriedades antigênicas. Essa variabilidade é facilitada pela destruição intensiva de células CD4+ e uma poderosa resposta de anticorpos à infecção pelo HIV. Uma nova forma de HIV, o HIV-2, biologicamente próximo ao HIV-1, mas imunologicamente diferente dele, foi isolada de pacientes da África Ocidental. A homologia da estrutura primária dos genomas desses vírus é de 42%. O DNA do provírus HIV-2 contém 9671 pb e seu LTR - 854 pb. O HIV-2 foi posteriormente isolado em outras regiões do mundo. Não há imunidade cruzada entre o HIV-1 e o HIV-2. Duas grandes formas de HIV-1 são conhecidas: O (Outlier) e M (Major), esta última dividida em 10 subtipos (AJ). Oito subtipos (AH) circulam na Rússia.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
O mecanismo de interação do HIV com a célula
Após penetrar no corpo, o vírus ataca primeiro as células que contêm o receptor CD4 específico. Esse receptor está presente em grandes quantidades nas células T auxiliares e em quantidades menores nos macrófagos e monócitos, sendo as células T auxiliares especialmente sensíveis ao vírus.
O vírus da imunodeficiência humana (HIV) reconhece os receptores CD4 usando sua proteína gpl20. O processo de interação do HIV com a célula ocorre de acordo com o seguinte esquema: adsorção mediada por receptor -> cavidade revestida -> vesícula revestida -> lisossomo. Nele, a membrana do vírion se funde com a membrana do lisossomo, e o nucleocapsídeo, liberado do supercapsídeo, entra no citoplasma; no caminho para o núcleo, ele é destruído, e o RNA genômico e os componentes do núcleo associados são liberados. Então, a transcriptase reversa sintetiza a fita negativa de DNA no RNA do vírion, então a RNase H destrói o RNA do vírion, e a DNA polimerase viral sintetiza a fita positiva de DNA. 5'-LTR e 3'-LTR são formadas nas extremidades do DNA provírus. O DNA provírus pode permanecer no núcleo por algum tempo em uma forma inativa, mas mais cedo ou mais tarde ele é integrado ao cromossomo da célula-alvo com a ajuda de sua integrase. Nele, o provírus permanece inativo até que o linfócito T em questão seja ativado por antígenos microbianos ou outras células imunocompetentes. A ativação da transcrição do DNA celular é regulada por um fator nuclear especial (NF-kB). É uma proteína de ligação ao DNA e é produzida em grandes quantidades durante a ativação e proliferação de linfócitos T e monócitos. Essa proteína se liga a certas sequências de DNA celular e sequências LTR semelhantes do DNA provírus e induz a transcrição tanto do DNA celular quanto do DNA provírus. Ao induzir a transcrição do DNA provírus, ela realiza a transição do vírus de um estado inativo para um ativo e, consequentemente, de uma infecção persistente para uma produtiva. O provírus pode permanecer em um estado inativo por um longo tempo. A ativação do vírus é um momento crítico em sua interação com a célula.
A partir do momento em que o vírus penetra na célula, inicia-se o período de infecção pelo HIV – o estado de portador do vírus, que pode durar 10 anos ou mais; e a partir do momento em que o vírus é ativado, inicia-se a doença – a AIDS. Com a ajuda de seus genes reguladores e seus produtos, o vírus começa a se reproduzir ativamente. A proteína TAT pode aumentar a taxa de reprodução do vírus em 1.000 vezes. A transcrição viral é complexa. Inclui a formação de mRNA completo e subgenômico, o splicing do mRNA e, em seguida, a síntese de proteínas estruturais e reguladoras.
A síntese de proteínas estruturais ocorre da seguinte forma. Primeiramente, a poliproteína precursora Pr55Gag (uma proteína com peso molecular de 55 kDa) é sintetizada. Ela contém 4 domínios principais: matriz (MA), capsídeo (CA), nucleocapsídeo (NC) e o domínio rb, a partir do qual, como resultado do corte de Pr55Gag pela protease viral (é autocortado de outra proteína precursora, Gag-Pol), as proteínas estruturais p17, p24, p7 e rb são formadas, respectivamente. A formação da poliproteína Pr55Gag é a principal condição para a formação de partículas virais. É essa proteína que determina o programa de morfogênese do vírion. Ela inclui sequencialmente as etapas de transporte da poliproteína Gag para a membrana plasmática, interação com ela e interações proteína-proteína durante a formação da partícula viral e seu brotamento. Pr55Gag é sintetizado em polirribossomos livres; As moléculas de proteína são transportadas para a membrana, onde são ancoradas por suas regiões hidrofóbicas. O domínio CA desempenha o papel principal na criação da conformação nativa da proteína Gag. O domínio NC garante a inclusão (com a ajuda de seus "dedos de zinco") de duas moléculas de RNA genômico na composição da partícula viral em formação. A molécula poliproteica inicialmente se dimeriza devido à interação dos domínios da matriz. Em seguida, os dímeros se combinam em complexos hexaméricos (de 6 unidades) como resultado da interação dos domínios CA e NC. Finalmente, os hexâmeros, unindo-se em suas superfícies laterais, formam vírions esféricos imaturos, dentro dos quais o RNA viral genômico está contido, capturado pelo domínio NC.
Outra proteína precursora, a Prl60Gag-Pol (uma proteína com peso molecular de 160 kDa), é sintetizada como resultado de um deslocamento de estrutura pelo ribossomo durante a tradução da extremidade 3' do gene gag na região imediatamente a montante da região que codifica a proteína rb. Essa poliproteína Gag-Pol contém uma sequência incompleta da proteína Gag (1-423 aminoácidos) e sequências Pol que incluem os domínios PR, RT e IN. As moléculas da poliproteína Gag-Pol também são sintetizadas em polirribossomos livres e transportadas para a membrana plasmática. A poliproteína Prl60Gagpol contém todos os sítios de interação intermolecular e sítios de ligação à membrana inerentes à poliproteína Gag. Portanto, as moléculas da poliproteína Gag-Pol fundem-se com a membrana e, juntamente com as moléculas Gag, são incluídas nos vírions em formação, resultando no surgimento da protease ativa e no início do processo de maturação do vírion. A protease do HIV-1 é altamente ativa apenas na forma de dímero; portanto, para sua autoexcisão de Prl60Gag-Pol, é necessária a dimerização dessas moléculas. A maturação do vírion consiste no fato de que a protease ativa liberada corta prl60Gag-Pol e Gag55 nos locais por ela reconhecidos; as proteínas p17, p24, p7, p6, revertase e integrase são formadas e sua associação à estrutura viral ocorre.
A proteína Env é sintetizada nos ribossomos associados às membranas do retículo endoplasmático, sendo então glicosilada, dividida por uma protease celular em gp120 e gp41 e transportada para a superfície celular. Nesse caso, a gp41 penetra na membrana e se liga aos domínios da matriz da molécula da proteína Gag associada à superfície interna da membrana. Essa conexão é preservada no vírion maduro.
Assim, a montagem de partículas virais consiste na agregação de proteínas precursoras e moléculas de RNA associadas na membrana plasmática da célula hospedeira, na formação de vírions imaturos e sua liberação por brotamento da superfície celular. Durante o brotamento, o vírion envolve-se com uma membrana celular na qual as moléculas gp41 e gp120 são incorporadas. Durante o brotamento ou, possivelmente, após a liberação dos vírions, ocorre sua maturação, que é realizada com a ajuda de uma protease viral e consiste no corte proteolítico das proteínas precursoras Pr55Gag e Prl60Gag-Pol em proteínas do vírus maduro e sua associação em certos complexos estruturais. O papel principal nos processos de morfogênese viral é desempenhado pela poliproteína precursora Pr55Gag, que organiza e monta o vírion imaturo; o processo de sua maturação é completado por uma protease viral específica.
Causas da imunodeficiência
Uma das principais causas da imunodeficiência na infecção pelo HIV é a morte em massa de células T auxiliares. Ela ocorre como resultado dos seguintes eventos. Primeiro, as células T auxiliares infectadas pelo vírus morrem devido à apoptose. Acredita-se que, em pacientes com AIDS, a replicação viral, a apoptose e a diminuição do número de células T auxiliares estejam interligadas. Segundo, as células T assassinas reconhecem e destroem células T infectadas pelo vírus ou portadoras de moléculas gpl20 adsorvidas, bem como células T auxiliares infectadas e não infectadas pelo vírus, que formam simplastos (sincícios) compostos por várias dezenas de células (algumas delas morrem como resultado da reprodução do vírus nelas). Como resultado da destruição de um grande número de células T auxiliares, ocorre uma diminuição na expressão de receptores de membrana nos linfócitos B para a interleucina-2, a síntese de várias interleucinas (fatores de crescimento e diferenciação dos linfócitos B - IL-4, IL-5, IL-6, etc.) é interrompida, resultando na interrupção da função do sistema T-killer. A atividade dos sistemas complemento e macrófago é suprimida. Macrófagos e monócitos infectados pelo vírus não morrem por muito tempo, mas não são capazes de remover o vírus do corpo. Finalmente, devido à similaridade estrutural e antigênica da gpl20 com os receptores de algumas células epiteliais do corpo (incluindo receptores trofoblásticos que mediam a transmissão do HIV por transplante), são sintetizados anticorpos antirreceptores com amplo espectro de ação. Esses anticorpos são capazes de bloquear vários receptores celulares e complicar o curso da doença com distúrbios autoimunes. A consequência da infecção pelo HIV é a derrota de todos os principais elos do sistema imunológico. Esses pacientes tornam-se indefesos contra uma ampla variedade de microrganismos. Isso leva ao desenvolvimento de infecções oportunistas e tumores. Para pacientes com infecção pelo HIV, o risco de desenvolver pelo menos três tipos de câncer é aumentado: sarcoma de Kaposi; carcinoma (incluindo câncer de pele); linfoma de células B, que ocorre devido à transformação maligna dos linfócitos B. No entanto, o HIV não é apenas linfocitotrópico, mas também neurotrópico. Ele penetra nas células do sistema nervoso central (astrócitos) tanto por endocitose mediada por receptor quanto por fagocitose de linfoblastos infectados pelo vírus pelos astrócitos. Quando o vírus interage com os astrócitos, também são formados simplastos, que facilitam a disseminação do patógeno pelos canais intercelulares. O vírus pode persistir em macrófagos e monócitos por um longo tempo, então eles servem como reservatório e distribuidores dele no corpo, sendo capazes de penetrar em todos os tecidos. Macrófagos infectados desempenham um papel importante na introdução do HIV no sistema nervoso central e em seus danos. Em 10% dos pacientes, as síndromes clínicas primárias estão associadas a danos no sistema nervoso central e se manifestam como demência. Assim, as pessoas infectadas pelo HIV são caracterizadas por três grupos de doenças: infecções oportunistas,doenças tumorais e danos ao sistema nervoso central.
Epidemiologia da infecção pelo HIV
A fonte de infecção pelo HIV é apenas uma pessoa – uma pessoa doente ou portadora do vírus. O vírus da imunodeficiência humana (HIV) está presente no sangue, no esperma e no fluido cervical; em mães que amamentam, no leite materno. A infecção ocorre sexualmente, através do sangue e suas preparações, bem como da mãe para o filho antes, durante e após o parto. Não são conhecidos casos de infecção pelo vírus através de alimentos, bebidas e picadas de insetos.
A dependência química contribui para a disseminação da AIDS. A incidência do HIV cresce a cada ano. Segundo a OMS, de 1980 a 2000, 58 milhões de pessoas foram infectadas pelo HIV. Só em 2000, 5,3 milhões de pessoas foram infectadas em todo o mundo e 3 milhões morreram de AIDS. Em 1º de janeiro de 2004, 264 mil pessoas infectadas pelo HIV estavam registradas na Rússia. Metade das pessoas infectadas pelo HIV morrem dentro de 11 a 12 anos após a infecção. No início de 2004, de cada 100 mil cidadãos russos, cerca de 180 viviam com o diagnóstico de "infecção pelo HIV". Prevê-se que, com esse nível de morbidade, o número total de pessoas infectadas pelo HIV na Rússia até 2012 seja de 2,5 a 3 milhões de pessoas. A complexidade do combate à infecção pelo HIV depende de uma série de razões: em primeiro lugar, não existem métodos eficazes de tratamento e prevenção específica; Em segundo lugar, o período de incubação da infecção pelo HIV pode exceder 10 anos. Sua duração depende do momento da ativação do linfócito T e do DNA provírus contido em seu cromossomo. Ainda não está claro se todos os infectados com o vírus estão fadados à AIDS ou se o transporte a longo prazo do vírus sem doença é possível (o que parece improvável). Finalmente, existem vários vírus da imunodeficiência humana (HIV-1, HIV-2), cujas diferenças antigênicas impedem a formação de imunidade cruzada. A descoberta do vírus da imunodeficiência símia (SIV) lançou luz sobre a questão da origem do HIV. O SIV é semelhante ao HIV em sua organização genômica, mas difere significativamente em sua sequência de nucleotídeos. O HIV-2 ocupa uma posição intermediária entre o HIV-1 e o SIV em suas propriedades sorológicas e está mais próximo do SIV em sua sequência de nucleotídeos. Nesse sentido, VM Zhdanov sugeriu que os vírus HIV-1, HIV-2 e SIV se originaram de um ancestral comum. É possível, segundo R. Gallo, que um dos SIVs tenha entrado de alguma forma no corpo humano, onde sofreu uma série de mutações, resultando no surgimento do HIV-1, HIV-2 e suas outras formas.
Sintomas da infecção pelo HIV
O vírus da imunodeficiência humana possui algumas características que determinam em grande parte a patogênese da doença. O vírus tem uma taxa de reprodução muito alta, determinada por seus elementos reguladores (até 5.000 vírions são sintetizados em 5 minutos na fase ativa). Devido à presença da proteína de fusão (gp41), o vírus induz a formação de extensas estruturas sinciciais devido à fusão de células T auxiliares infectadas e não infectadas, o que resulta em sua morte em massa. As moléculas da proteína gpl20 formadas em grandes quantidades circulam livremente no sangue e se ligam aos receptores das células T auxiliares não infectadas, sendo também reconhecidas e destruídas pelas células T killer. O vírus pode se espalhar através de canais intercelulares de célula para célula, tornando-se, nesse caso, pouco acessível aos anticorpos.
Critérios clínicos para infecção pelo HIV
Em adultos, a infecção pelo HIV é diagnosticada quando apresentam pelo menos dois sintomas graves em combinação com pelo menos um sintoma leve e na ausência de outras causas conhecidas de imunodeficiência (câncer, imunodeficiência congênita, inanição grave, etc.). Os sintomas graves incluem:
- perda de peso de 10% ou mais;
- uma condição febril prolongada, intermitente ou constante;
- diarreia crônica.
Sintomas leves: tosse persistente, dermatite generalizada, herpes zoster recorrente, candidíase oral e faríngea, herpes simplex crônico, linfadenopatia generalizada. O diagnóstico de AIDS é feito apenas na presença de sarcoma de Kaposi, meningite criptocócica e pneumonia pneumocística. O quadro clínico da doença é influenciado pela infecção oportunista associada.
Métodos de cultivo do vírus da imunodeficiência humana (HIV)
O HIV-1 e o HIV-2 podem ser cultivados em células de apenas um clone de linfócitos TCV4 - H9, obtido de linfócitos TCV4 leucêmicos. Culturas em monocamada de células de astrócitos, nas quais o HIV-1 se reproduz bem, também podem ser utilizadas para esses fins. Os chimpanzés são suscetíveis ao HIV-1 entre os animais.
A resistência do vírus no ambiente externo é baixa. Ele morre sob a influência da luz solar e da radiação UV, sendo destruído a 80 °C em 30 minutos, quando tratado com desinfetantes comumente usados, em 20 a 30 minutos. Para desinfetar materiais contendo vírus, é necessário o uso de desinfetantes micobactericidas, pois são eficazes contra microrganismos com maior resistência.
Diagnóstico laboratorial da infecção pelo HIV
O principal método para diagnosticar a transmissão do vírus e a infecção pelo HIV é o ensaio imunoenzimático. No entanto, devido ao fato de que o gpl20 possui similaridade estrutural e antigênica com receptores de algumas células humanas, incluindo receptores que transportam imunoglobulinas através de células epiteliais das membranas mucosas, anticorpos relacionados aos anticorpos contra o gpl20 podem aparecer no corpo. Nesse caso, pode haver resultados falso-positivos de ELISA. Portanto, todos os soros reagentes positivos dos indivíduos são submetidos a análises adicionais usando o método de immunoblotting ou Western blotting. Este método baseia-se na identificação dos anticorpos em estudo após sua separação eletroforética e subsequente teste usando anticorpos anti-espécies marcados. O método virológico raramente é usado devido à complexidade da cultura do vírus. O clone de linfócitos H9 é usado para obter antígenos virais - os componentes necessários dos sistemas de teste diagnóstico. O método CPR permite a detecção do vírus em um estágio inicial da viremia.
Tratamento da infecção pelo HIV
É necessário encontrar ou sintetizar fármacos que suprimam eficazmente a atividade da transcriptase reversa (revertase) ou da protease viral. Esses fármacos impediriam a formação do DNA do provírus e (ou) inibiriam a reprodução intracelular do vírus. A estratégia moderna para o tratamento de pacientes infectados pelo HIV baseia-se no princípio do uso combinado de fármacos que inibem a protease viral (um dos fármacos) e a reversease (dois fármacos diferentes) – terapia combinada (tripla). Na Rússia, para o tratamento de pacientes infectados pelo HIV, recomenda-se o uso combinado de dois fármacos nacionais: fosfazida e crixivan, que suprimem especificamente a reprodução do HIV nas fases inicial e tardia da reprodução, especialmente com atividade reduzida da azidotimidina.
O problema da profilaxia específica é a necessidade de criar uma vacina que garanta a formação de imunidade celular eficaz com base em linfócitos citotóxicos específicos do vírus, sem qualquer produção significativa de anticorpos. Essa imunidade é fornecida por auxiliares Thl. É possível que os anticorpos, incluindo os neutralizantes do vírus, não sejam apenas ineficazes na supressão da infecção pelo HIV, mas, em alto nível, suprimam a imunidade celular. Portanto, uma vacina anti-HIV deve atender, em primeiro lugar, a dois requisitos principais: a) ser absolutamente segura e b) estimular a atividade de linfócitos T citotóxicos. A eficácia de várias variantes de vacina obtidas a partir de vírus mortos (inativados) e de antígenos individuais com altas propriedades protetoras está sendo estudada. Esses antígenos podem ser isolados dos próprios vírions ou sintetizados quimicamente. Uma vacina criada com base em métodos de engenharia genética foi proposta. Trata-se de um vírus vacínia recombinante que carrega genes do HIV responsáveis pela síntese de antígenos com fortes propriedades imunogênicas. A questão da eficácia dessas vacinas requer um tempo considerável devido ao longo período de incubação da infecção pelo HIV e à alta variabilidade do patógeno. A criação de uma vacina altamente eficaz contra o HIV é uma questão fundamental e urgente.

