
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Síntese, secreção e metabolismo das catecolaminas
Médico especialista do artigo
Última revisão: 06.07.2025
A medula adrenal produz compostos com uma estrutura diferente dos esteroides. Eles contêm um núcleo 3,4-di-hidroxifenil (catecol) e são chamados de catecolaminas. Entre eles estão a adrenalina, a noradrenalina e a dopamina beta-hidroxitiramina.
A sequência de síntese das catecolaminas é bastante simples: tirosina → di-hidroxifenilalanina (DOPA) → dopamina → norepinefrina → adrenalina. A tirosina entra no corpo com os alimentos, mas também pode ser formada a partir da fenilalanina no fígado, sob a ação da fenilalanina hidroxilase. Os produtos finais da conversão da tirosina nos tecidos são diferentes. Na medula adrenal, o processo prossegue para a fase de formação da adrenalina; nas terminações dos nervos simpáticos, para a norepinefrina; em alguns neurônios do sistema nervoso central, a síntese de catecolaminas termina com a formação da dopamina.
A conversão de tirosina em DOPA é catalisada pela tirosina hidroxilase, cujos cofatores são a tetra-hidrobiopterina e o oxigênio. Acredita-se que essa enzima limite a velocidade de todo o processo de biossíntese de catecolaminas e seja inibida pelos produtos finais do processo. A tirosina hidroxilase é o principal alvo dos efeitos regulatórios na biossíntese de catecolaminas.
A conversão de DOPA em dopamina é catalisada pela enzima DOPA descarboxilase (cofator - fosfato de piridoxal), que é relativamente inespecífica e descarboxila outros L-aminoácidos aromáticos. No entanto, há indícios da possibilidade de modificar a síntese de catecolaminas alterando a atividade dessa enzima. Alguns neurônios não possuem enzimas para a conversão posterior de dopamina, sendo esta o produto final. Outros tecidos contêm dopamina beta-hidroxilase (cofatores - cobre, ácido ascórbico e oxigênio), que converte dopamina em norepinefrina. Na medula adrenal (mas não nas terminações dos nervos simpáticos), está presente a feniletanolamina - uma metiltransferase que forma adrenalina a partir da norepinefrina. Nesse caso, a S-adenosilmetionina atua como doadora de grupos metil.
É importante lembrar que a síntese de feniletanolamina-N-metiltransferase é induzida por glicocorticoides que entram na medula a partir do córtex através do sistema venoso portal. Isso pode explicar o fato de duas glândulas endócrinas diferentes serem combinadas em um único órgão. A importância dos glicocorticoides para a síntese de adrenalina é enfatizada pelo fato de que as células da medula adrenal que produzem noradrenalina estão localizadas ao redor dos vasos arteriais, enquanto as células produtoras de adrenalina recebem sangue principalmente dos seios venosos localizados no córtex adrenal.
A degradação das catecolaminas ocorre principalmente sob a influência de dois sistemas enzimáticos: a catecol-O-metiltransferase (COMT) e a monoamina oxidase (MAO). As principais vias de degradação da adrenalina e da noradrenalina são mostradas esquematicamente na Figura 54. Sob a influência da COMT, na presença do doador de grupo metil S-adrenosilmetionina, as catecolaminas são convertidas em normetanefrina e metanefrina (derivados 3-O-metil da noradrenalina e da adrenalina), que, sob a influência da MAO, são convertidas em aldeídos e, em seguida (na presença da aldeído oxidase), em ácido vanililmandélico (VMA), o principal produto de degradação da noradrenalina e da adrenalina. No mesmo caso, quando as catecolaminas são inicialmente expostas à MAO em vez da COMT, elas são convertidas em aldeído 3,4-dioxomandélico e, em seguida, sob a influência da aldeído oxidase e da COMT, em ácido 3,4-dioxomandélico e VMC. Na presença da álcool desidrogenase, o 3-metoxi-4-oxifenilglicol, que é o principal produto final da degradação da adrenalina e da noradrenalina no SNC, pode ser formado a partir das catecolaminas.
A degradação da dopamina é semelhante, exceto que seus metabólitos não possuem o grupo hidroxila no átomo de carbono beta e, portanto, em vez de ácido vanililmandélico, é formado ácido homovanílico (HVA) ou ácido 3-metoxi-4-hidroxifenilacético.
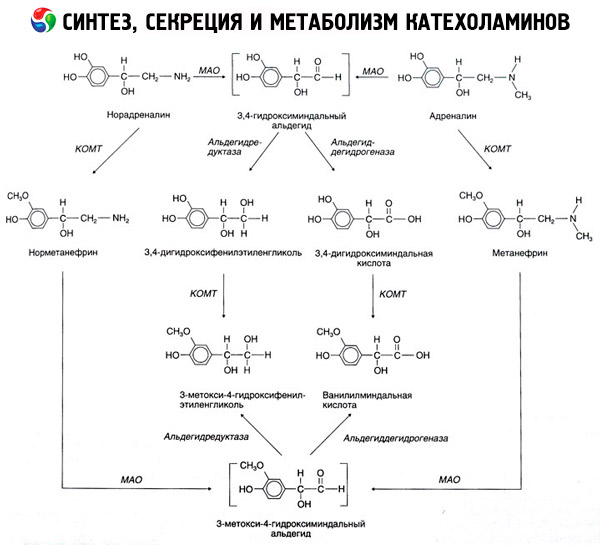
Também é postulada a existência de uma via quinoide de oxidação da molécula de catecolamina, que pode produzir produtos intermediários com atividade biológica pronunciada.
A norepinefrina e a adrenalina, formadas sob a ação de enzimas citosólicas nas terminações nervosas simpáticas e na medula adrenal, entram nos grânulos secretores, que os protegem da ação de enzimas de degradação. A captura de catecolaminas pelos grânulos requer gasto energético. Nos grânulos cromafins da medula adrenal, as catecolaminas estão fortemente ligadas ao ATP (numa proporção de 4:1) e a proteínas específicas – as cromograninas –, o que impede a difusão de hormônios dos grânulos para o citoplasma.
O estímulo direto para a secreção de catecolaminas é aparentemente a penetração de cálcio na célula, estimulando a exocitose (fusão da membrana granular com a superfície celular e sua ruptura com a liberação completa do conteúdo solúvel - catecolaminas, dopamina beta-hidroxilase, ATP e cromograninas - para o fluido extracelular).
Efeitos fisiológicos das catecolaminas e seu mecanismo de ação
Os efeitos das catecolaminas começam com a interação com receptores específicos das células-alvo. Enquanto os receptores para hormônios tireoidianos e esteroides estão localizados dentro das células, os receptores para catecolaminas (assim como para acetilcolina e hormônios peptídicos) estão presentes na superfície externa da célula.
Há muito tempo se estabeleceu que, em relação a algumas reações, a adrenalina ou a noradrenalina são mais eficazes do que a catecolamina sintética isoproterenol, enquanto em relação a outras, o efeito do isoproterenol é superior às ações da adrenalina ou da noradrenalina. Com base nisso, foi desenvolvido um conceito sobre a presença de dois tipos de adrenoreceptores nos tecidos: alfa e beta, e em alguns deles apenas um desses dois tipos pode estar presente. O isoproterenol é o agonista mais potente dos adrenoreceptores beta, enquanto o composto sintético fenilefrina é o agonista mais potente dos adrenoreceptores alfa. As catecolaminas naturais - adrenalina e noradrenalina - são capazes de interagir com receptores de ambos os tipos, mas a adrenalina exibe uma afinidade maior para os receptores beta e a noradrenalina - para os receptores alfa.
As catecolaminas ativam os receptores beta-adrenérgicos cardíacos com mais intensidade do que os receptores beta do músculo liso, o que permitiu a divisão do tipo beta em subtipos: receptores beta1 (coração, células adiposas) e receptores beta2 (brônquios, vasos sanguíneos, etc.). O efeito do isoproterenol nos receptores beta1 excede o efeito da adrenalina e da noradrenalina em apenas 10 vezes, enquanto nos receptores beta2 ele atua de 100 a 1.000 vezes mais intensamente do que as catecolaminas naturais.
O uso de antagonistas específicos (fentolamina e fenoxibenzamina para receptores alfa e propranolol para receptores beta) confirmou a adequação da classificação dos adrenoreceptores. A dopamina é capaz de interagir com receptores alfa e beta, mas vários tecidos (cérebro, hipófise, vasos) também possuem seus próprios receptores dopaminérgicos, cujo bloqueador específico é o haloperidol. O número de receptores beta varia de 1.000 a 2.000 por célula. Os efeitos biológicos das catecolaminas mediados por receptores beta geralmente estão associados à ativação da adenilato ciclase e ao aumento do conteúdo intracelular de AMPc. Embora o receptor e a enzima estejam funcionalmente conectados, eles são macromoléculas diferentes. O trifosfato de guanosina (GTP) e outros nucleotídeos de purina participam da modulação da atividade da adenilato ciclase sob a influência do complexo hormônio-receptor. Ao aumentar a atividade enzimática, eles parecem reduzir a afinidade dos receptores beta pelos agonistas.
O fenômeno do aumento da sensibilidade de estruturas desnervadas é conhecido há muito tempo. Por outro lado, a exposição prolongada a agonistas reduz a sensibilidade dos tecidos-alvo. O estudo dos receptores beta tornou possível explicar esses fenômenos. Foi demonstrado que a exposição prolongada ao isoproterenol leva à perda de sensibilidade da adenilato ciclase devido à diminuição do número de receptores beta.
O processo de dessensibilização não requer ativação da síntese proteica e provavelmente se deve à formação gradual de complexos hormônio-receptor irreversíveis. Ao contrário, a introdução de 6-oxidopamina, que destrói as terminações simpáticas, é acompanhada por um aumento no número de receptores beta reagentes nos tecidos. É possível que um aumento na atividade nervosa simpática também cause dessensibilização dos vasos sanguíneos e do tecido adiposo relacionada à idade em relação às catecolaminas.
O número de adrenorreceptores em diferentes órgãos pode ser controlado por outros hormônios. Assim, o estradiol aumenta e a progesterona diminui o número de alfa-adrenorreceptores no útero, o que é acompanhado por um aumento e diminuição correspondentes em sua resposta contrátil às catecolaminas. Se o "segundo mensageiro" intracelular formado pela ação dos agonistas dos receptores beta é certamente o AMPc, então a situação em relação ao transmissor dos efeitos alfa-adrenérgicos é mais complicada. Supõe-se a existência de vários mecanismos: diminuição do nível de AMPc, aumento do conteúdo de AMPc, modulação da dinâmica do cálcio celular, etc.
Para reproduzir vários efeitos no corpo, geralmente são necessárias doses de adrenalina 5 a 10 vezes menores que as de noradrenalina. Embora esta última seja mais eficaz em relação aos receptores adrenérgicos alfa e beta1, é importante lembrar que ambas as catecolaminas endógenas são capazes de interagir com os receptores alfa e beta. Portanto, a resposta biológica de um determinado órgão à ativação adrenérgica depende em grande parte do tipo de receptores presentes nele. No entanto, isso não significa que a ativação seletiva da ligação nervosa ou humoral do sistema simpático-adrenal seja impossível. Na maioria dos casos, observa-se aumento da atividade de suas várias ligações. Assim, é geralmente aceito que a hipoglicemia ativa reflexivamente a medula adrenal, enquanto uma diminuição da pressão arterial (hipotensão postural) é acompanhada principalmente pela liberação de noradrenalina das terminações dos nervos simpáticos.
Adrenorreceptores e os efeitos de sua ativação em vários tecidos
Sistema, órgão |
Tipo de receptor adrenérgico |
Reação |
Sistema cardiovascular: |
||
Coração |
Beta |
Aumento da frequência cardíaca, condutividade e contratilidade |
Arteríolas: |
||
Pele e membranas mucosas |
Alfa |
Redução |
Músculos esqueléticos |
Beta |
Expansão Contração |
Órgãos abdominais |
Alfa (mais) |
Redução |
Beta |
Extensão |
|
Veias |
Alfa |
Redução |
Sistema respiratório: |
||
Músculos dos brônquios |
Beta |
Extensão |
Sistema digestivo: |
||
Estômago |
Beta |
Habilidades motoras diminuídas |
Intestinos |
Alfa |
Contração dos esfíncteres |
Baço |
Alfa |
Redução |
Beta |
Relaxamento |
|
Pâncreas exócrino |
Alfa |
Diminuição da secreção |
Sistema urogenital: |
Alfa |
Contração do esfíncter |
Bexiga |
Beta |
Relaxamento do músculo ejetor |
Genitália masculina |
Alfa |
Ejaculação |
Olhos |
Alfa |
Dilatação da pupila |
Couro |
Alfa |
Aumento da transpiração |
Glândulas salivares |
Alfa |
Excreção de potássio e água |
Beta |
Secreção de amilase |
|
Glândulas endócrinas: |
||
Ilhotas do pâncreas |
||
Células beta |
Alfa (mais) |
Diminuição da secreção de insulina |
Beta |
Aumento da secreção de insulina |
|
Células alfa |
Beta |
Aumento da secreção de glucagon |
8 células |
Beta |
Aumento da secreção de somatostatina |
Hipotálamo e glândula pituitária: |
||
Somatotróficos |
Alfa |
Aumento da secreção de STH |
Beta |
Diminuição da secreção de STH |
|
Lactotróficos |
Alfa |
Diminuição da secreção de prolactina |
Tireotrofos |
Alfa |
Diminuição da secreção de TSH |
Corticotróficos |
Alfa |
Aumento da secreção de ACTH |
| beta | Diminuição da secreção de ACTH | |
Glândula tireoide: |
||
Células foliculares |
Alfa |
Diminuição da secreção de tiroxina |
Beta |
Aumento da secreção de tiroxina |
|
Células parafoliculares (K) |
Beta |
Aumento da secreção de calcitonina |
Glândulas paratireoides |
Beta |
Aumento da secreção de PTH |
Rins |
Beta |
Aumento da secreção de renina |
Estômago |
Beta |
Aumento da secreção de gastrina |
BX |
Beta |
Aumento do consumo de oxigênio |
Fígado |
? |
Aumento da glicogenólise e da gliconeogênese com a liberação de glicose; aumento da cetogênese com a liberação de corpos cetônicos |
Tecido adiposo |
Beta |
Aumento da lipólise com liberação de ácidos graxos livres e glicerol |
Músculos esqueléticos |
Beta |
Aumento da glicólise com liberação de piruvato e lactato; diminuição da proteólise com diminuição da liberação de alanina e glutamina |
É importante considerar que os resultados da administração intravenosa de catecolaminas nem sempre refletem adequadamente os efeitos dos compostos endógenos. Isso se aplica principalmente à norepinefrina, uma vez que, no corpo, ela é liberada principalmente não no sangue, mas diretamente nas fendas sinápticas. Portanto, a norepinefrina endógena ativa, por exemplo, não apenas os receptores alfa vasculares (aumento da pressão arterial), mas também os receptores beta cardíacos (aumento da frequência cardíaca), enquanto a administração externa de norepinefrina leva principalmente à ativação dos receptores alfa vasculares e a uma desaceleração reflexa (via vago) dos batimentos cardíacos.
Baixas doses de adrenalina ativam principalmente os receptores beta dos vasos musculares e do coração, resultando em diminuição da resistência vascular periférica e aumento do débito cardíaco. Em alguns casos, o primeiro efeito pode prevalecer, e a hipotensão se desenvolve após a administração de adrenalina. Em doses mais altas, a adrenalina também ativa os receptores alfa, o que é acompanhado por um aumento da resistência vascular periférica e, em um contexto de aumento do débito cardíaco, leva a um aumento da pressão arterial. No entanto, seu efeito sobre os receptores beta vasculares também é preservado. Como resultado, o aumento da pressão sistólica excede o indicador similar da pressão diastólica (aumento da pressão de pulso). Com a introdução de doses ainda maiores, os efeitos alfa-miméticos da adrenalina começam a prevalecer: as pressões sistólica e diastólica aumentam paralelamente, como sob a influência da norepinefrina.
O efeito das catecolaminas no metabolismo consiste em seus efeitos diretos e indiretos. Os primeiros são realizados principalmente por meio dos receptores beta. Processos mais complexos estão associados ao fígado. Embora o aumento da glicogenólise hepática seja tradicionalmente considerado resultado da ativação do receptor beta, também há evidências do envolvimento do receptor alfa. Os efeitos indiretos das catecolaminas estão associados à modulação da secreção de muitos outros hormônios, como a insulina. No efeito da adrenalina sobre sua secreção, o componente alfa adrenérgico predomina claramente, uma vez que foi demonstrado que qualquer estresse é acompanhado pela inibição da secreção de insulina.
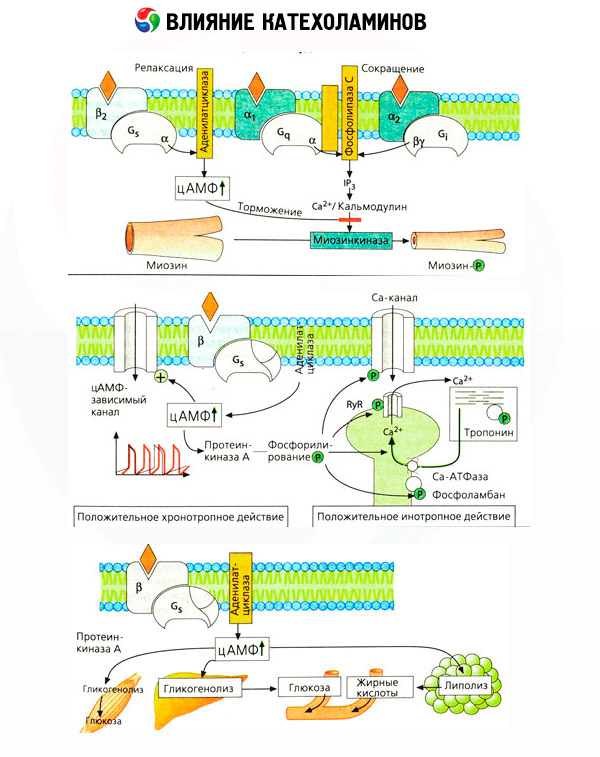
A combinação dos efeitos diretos e indiretos das catecolaminas causa hiperglicemia, associada não apenas ao aumento da produção hepática de glicose, mas também à inibição de sua utilização pelos tecidos periféricos. A aceleração da lipólise causa hiperlipidemia com aumento da oferta de ácidos graxos para o fígado e intensificação da produção de corpos cetônicos. O aumento da glicólise nos músculos leva a um aumento na liberação de lactato e piruvato no sangue, que, juntamente com o glicerol liberado do tecido adiposo, atuam como precursores da gliconeogênese hepática.
Regulação da secreção de catecolaminas. A similaridade dos produtos e métodos de reação do sistema nervoso simpático e da medula adrenal foi a base para a combinação dessas estruturas em um único sistema simpático-adrenal do corpo, com a alocação de suas ligações nervosas e hormonais. Diversos sinais aferentes concentram-se no hipotálamo e nos centros da medula espinhal e da medula oblonga, de onde se originam as mensagens eferentes, que são direcionadas aos corpos celulares dos neurônios pré-ganglionares localizados nos cornos laterais da medula espinhal, ao nível dos segmentos VIII cervical - II-III lombar.
Os axônios pré-ganglionares dessas células deixam a medula espinhal e formam conexões sinápticas com neurônios localizados nos gânglios da cadeia simpática ou com células da medula adrenal. Essas fibras pré-ganglionares são colinérgicas. A primeira diferença fundamental entre os neurônios pós-ganglionares simpáticos e as células cromafins da medula adrenal é que estas últimas transmitem o sinal colinérgico recebido por elas não por condução nervosa (nervos adrenérgicos pós-ganglionares), mas pela via humoral, liberando compostos adrenérgicos no sangue. A segunda diferença é que os nervos pós-ganglionares produzem norepinefrina, enquanto as células da medula adrenal produzem principalmente adrenalina. Essas duas substâncias têm efeitos diferentes nos tecidos.

