
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
“Oxigênio para células”: um implante simples ajudou a reduzir os níveis de açúcar sem medicamentos fortes
Última revisão: 18.08.2025
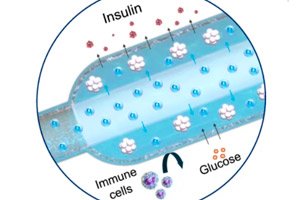 ">
">Um novo implante de "oxigênio" para o tratamento do diabetes tipo 1 foi descrito na Nature Communications: um gerador eletroquímico compacto de oxigênio (iEOG) fornece continuamente O₂ a uma macrocápsula com células secretoras de insulina. Este sistema permite o compactamento de ilhotas isoladas (até 60.000 IEQ/ml) e mantém sua viabilidade e secreção mesmo em condições de baixo nível de oxigênio. Em ratos com diabetes, o dispositivo implantado sob a pele manteve os níveis de açúcar normais por até três meses — sem imunossupressão. Os ratos do grupo controle, sem oxigênio, permaneceram hiperglicêmicos.
Fundo
- O principal problema técnico é o oxigênio. Assim que "escondemos" as células atrás da membrana e colocamos o dispositivo sob a pele (removível de forma conveniente e fácil), elas ficam sem oxigênio: a difusão através da membrana e o local pouco vascularizado não atendem às necessidades das ilhotas "vorazes". Daí a morte precoce, o trabalho fraco e a necessidade de diluir bastante a semeadura – caso contrário, a cápsula fica enorme.
- Por que é tão difícil fisicamente? O oxigênio atravessa os tecidos apenas por distâncias muito curtas, e as células encapsuladas não possuem vasos próprios – nos primeiros meses, elas sobrevivem apenas por difusão passiva. Qualquer espessamento de materiais ou "compactação" de células transfere rapidamente o centro da cápsula para a hipóxia.
- O que você já tentou antes?
- Eles criaram macrodispositivos recarregáveis com oxigênio (por exemplo, o βAir): há um reservatório interno que é reabastecido com oxigênio diariamente; houve ensaios pré-clínicos e clínicos iniciais. Funciona, mas exige muito trabalho do paciente.
- Doadores químicos de O₂ e materiais "transportadores" (compostos perfluoro) foram testados: eles ajudam, mas produzem um efeito curto e difícil de controlar. Estruturas de "ar" para acelerar a liberação de O₂ na espessura do gel também surgiram.
- As próprias cápsulas e os locais de implantação (membranas finas, pré-vascularização) foram melhorados, mas sem uma fonte externa de O₂ eles ainda atingem os limites de densidade celular.
- Que lacuna no quebra-cabeça o novo trabalho preenche? Os autores da Nature Communications mostram um suprimento contínuo de oxigênio a partir de um minigerador dentro do sistema de macroencapsulação: o dispositivo retira água dos tecidos e libera eletroquimicamente O₂, que "respira" uniformemente ao longo da cápsula com células. A ideia é dar à cápsula seu "próprio compressor de aquário" para que ela possa compactar mais células e ainda mantê-las vivas e funcionando – mesmo em um local subcutâneo, pouco "oxigenado".
Por que isso é necessário?
O transplante de ilhotas ou células beta é um dos caminhos mais promissores para uma "cura funcional" para o diabetes tipo 1. Mas existem duas barreiras principais:
- Imunidade - geralmente requer imunossupressores por toda a vida;
- Falta de oxigênio — as cápsulas que protegem o sistema imunológico isolam simultaneamente as células dos vasos sanguíneos, e as células beta, vorazes por O₂, rapidamente "sufocam". O novo trabalho atinge a segunda barreira: fornece à cápsula sua própria fonte controlada de oxigênio.
Como funciona o implante
- Duas partes. Em uma caixa de titânio, há um minigerador de oxigênio (iEOG), que extrai água do fluido intersticial e libera O₂ por eletrólise; ao lado dele, há uma fina cápsula linear com células (semelhante a uma longa "salsicha"), através da qual passa um tubo permeável a gases: o oxigênio é absorvido uniformemente por toda a cápsula. Entre as células e os tecidos, há uma membrana semipermeável (eletrofia + alginato): glicose e insulina passam, mas as células imunes não.
- Dimensões: A segunda versão do iEOG tem 13 mm de diâmetro e 3,1 mm de espessura, pesando cerca de 2 g. Quando combinado com uma cápsula, esse sistema pode ser inserido e removido por meio de uma pequena incisão, o que é importante para a segurança.
- Produtividade. O gerador produz ~1,9–2,3 cm³ O₂/h e mantém o fluxo especificado por meses e até anos (em testes de longo prazo em solução salina — até 2,5 anos), e após a implantação em ratos, esse nível foi mantido. Esse fluxo é calculado para cobrir as necessidades de centenas de milhares de equivalentes de ilhotas — a ordem de grandeza que uma pessoa precisa.
O que os experimentos mostraram
- In vitro: A 1% O₂ (hipóxia grave), a oxigenação manteve a viabilidade e a secreção em agregados de INS-1 e em ilhotas humanas compactadas em uma camada muito densa (60.000 IEQ/mL).
- In vivo (ratos). Após implantação subcutânea em um modelo de diabetes alogênico, o sistema iEOG normalizou a glicemia por até 3 meses sem imunossupressão; dispositivos sem oxigênio não apresentaram efeito. A histologia ao redor do gerador não mostrou reações adversas significativas.
Por que isso é importante para a clínica?
- Um passo em direção a "dimensões realistas". Para fornecer a um adulto uma dose de 300 a 770 mil IEQ, a cápsula precisa ser compactada – isso sempre foi limitado pelo oxigênio. O fornecimento controlado de O₂ "remove o teto" de densidade e permite tornar o dispositivo compacto o suficiente para uma implantação real.
- Mais conveniência. Anteriormente, experimentamos doadores químicos de oxigênio (peróxidos) – eles não funcionam por muito tempo e são incontroláveis –, bem como reservatórios de O₂ com "reabastecimento" diário pela pele – incômodos e inconvenientes. Aqui, o oxigênio é fornecido constantemente e em doses medidas, sem injeções.
Detalhes técnicos que impressionam
- A fonte de água é o tecido. O iEOG absorve o vapor do fluido intersticial através de uma “janela” porosa e, em seguida, um conjunto clássico de membrana-eletrodo (MEA) e uma voltagem de 1,4–1,8 V são usados para separar a água em H₂ e O₂; os gases são removidos por diferentes canais.
- Durabilidade. Três dispositivos em solução salina operaram por 11 meses, 2 anos e 2,5 anos em corrente contínua sem degradação pelo fluxo de oxigênio; após implantação em ratos imunodeficientes e imunocompetentes, o desempenho foi mantido.
Limitações e "o que vem a seguir"
Isso ainda é pré-clínico: ratos, alta densidade na cápsula, fornecimento de oxigênio - tudo está ótimo, mas testes importantes estão por vir:
- escalonamento para doses e prazos humanos;
- confiabilidade e fornecimento de energia de eletroquímicos no corpo humano por anos (a arquitetura de fornecimento de energia não é detalhada no artigo);
- minimização da fibrose ao redor das cápsulas e estabilidade da difusão;
- testes em células-tronco beta e em modelos mais próximos dos humanos. Os autores comparam abertamente sua solução com abordagens anteriores e a posicionam como uma plataforma para cápsulas clinicamente traduzíveis.
Conclusão
Para que as células beta transplantadas vivam e funcionem sem imunossupressores, elas precisam respirar. A equipe de Cornell e seus parceiros demonstrou que um minigerador de oxigênio embutido em uma cápsula linear pode "alimentar" as células com O₂ por tempo e de forma uniforme o suficiente para que elas suportem alta densidade e reduzam o açúcar, mesmo em uma localização subcutânea. A prática clínica ainda está longe, mas a lógica da engenharia é simples e bela: dar às células ar onde falta.
