
Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Vitamina K₂ de uma nova maneira: como um micróbio “queijo” ensinou os cientistas a tornar as vitaminas mais baratas e ecológicas
Última revisão: 18.08.2025
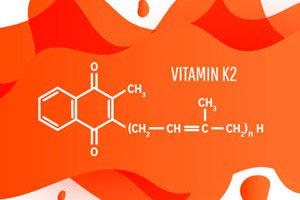 ">
">Uma equipe da Rice University descobriu por que a bactéria Lactococcus lactis (a mesma "fera de carga" segura dos queijos e do kefir) se recusa teimosamente a produzir uma quantidade excessiva do precursor da vitamina K₂ — e como "remover cuidadosamente os limitadores". Descobriu-se que as células equilibram entre o benefício (as quinonas são necessárias para a produção de energia) e a toxicidade (seu excesso desencadeia estresse oxidativo). Cientistas montaram um biossensor supersensível, "colocaram fios" nas vias de síntese e conectaram um modelo matemático. Conclusão: duas "cortinas" interferem ao mesmo tempo — a regulação inerente da via e a ausência do substrato inicial; além disso, até mesmo a ordem dos genes no DNA é importante. Se você ajustar três botões juntos (substrato → enzimas → ordem dos genes), o teto de produção pode ser aumentado. O trabalho foi publicado na mBio em 11 de agosto de 2025.
Contexto do estudo
- Por que todos precisam de vitamina K₂? As menaquinonas (vitamina K₂) são importantes para a coagulação sanguínea, a saúde óssea e provavelmente para os vasos sanguíneos. A demanda por suplementos está crescendo, e a síntese química clássica é cara e não é a mais ecológica. A solução lógica é produzir K₂ por fermentação em bactérias alimentares seguras.
- Por que Lactococcus lactis? É o animal de carga da indústria de laticínios, com status GRAS. É fácil de cultivar, seguro e já utilizado em alimentos – a base perfeita para transformar o micróbio em uma biofábrica de vitaminas.
- Onde está o verdadeiro beco sem saída? A via de biossíntese do K₂ passa por intermediários quinônicos reativos. Por um lado, eles são necessários à célula (energia, transferência de elétrons), mas, por outro, em excesso, tornam-se tóxicos (estresse oxidativo). Portanto, mesmo que você "ajuste" as enzimas, a própria célula impõe limites à taxa de fluxo.
- O que faltava antes.
- Medições precisas de metabólitos intermediários instáveis - eles são difíceis de "detectar" com métodos padrão.
- Entender se a baixa produção é devida à regulação da via, à falta de substrato inicial ou... à arquitetura frequentemente negligenciada do operon (a ordem dos genes no DNA).
- Por que este trabalho. Os autores precisavam:
- criar um biossensor sensível para finalmente medir os intermediários “escorregadios”;
- montar um modelo de toda a cascata e descobrir onde estão os verdadeiros “gargalos”;
- para testar como três botões afetam simultaneamente a liberação — fornecimento de substrato, níveis de enzimas-chave e a ordem dos genes — e se é possível romper o teto natural girando-os em conjunto.
- Sentido prático. Se você entender exatamente onde o micróbio "desacelera", poderá desenvolver linhagens que produzam mais vitaminas com os mesmos recursos, tornando a produção mais barata e ecologicamente correta. Isso também é útil para outras vias em que quinonas "úteis" estão à beira da toxicidade – de vitaminas a precursores de medicamentos.
O que exatamente eles fizeram?
- Um produto intermediário invisível foi detectado. O precursor a partir do qual todas as formas de vitamina K₂ (menaquinona) são formadas é muito instável. Para "vê-lo", um biossensor personalizado foi criado em outra bactéria — a sensibilidade aumentou milhares de vezes, e equipamentos simples de laboratório foram suficientes para as medições.
- Eles modificaram a genética e a compararam com o modelo. Os pesquisadores alteraram os níveis de enzimas-chave da via e compararam a liberação real do precursor com as previsões do modelo. Enquanto o modelo considerava que o substrato era "infinito", tudo divergia. Valeu a pena considerar o esgotamento do início, e as previsões "se concretizaram": estamos nos deparando não apenas com enzimas, mas também com matérias-primas para a via.
- O papel da "arquitetura" do DNA foi descoberto. Até mesmo a ordem dos genes na cascata enzimática afeta o nível do produto intermediário instável. O rearranjo produziu mudanças perceptíveis – isso significa que a evolução também usa a geometria do genoma como regulador.
Principais descobertas em termos simples
- L. lactis mantém precursor suficiente para sobreviver e crescer sem sofrer toxicidade. Simplesmente "adicionar enzimas" não ajuda se não houver substrato suficiente: é como colocar mais assadeiras sem adicionar farinha.
- O "teto" de produção é definido por dois fatores: a regulação interna da via e a disponibilidade da fonte. Além de tudo isso, há a ordem dos genes no operon. Ajustar três níveis simultaneamente permite ir além do limite natural.
Por que isso é necessário?
- A vitamina K₂ é importante para a coagulação sanguínea, os ossos e provavelmente a saúde vascular. Atualmente, ela é obtida por síntese química ou extração de matérias-primas — o que é caro e pouco ecológico. A engenharia de bactérias alimentícias seguras oferece a oportunidade de produzir K₂ por fermentação — mais barato e "mais ecológico".
- Entender onde estão os “freios” no caminho da síntese é um mapa para os produtores: é possível criar cepas que produzam mais vitamina na mesma quantidade de ração e área e, no futuro, até mesmo probióticos que sintetizem K₂ diretamente no produto ou nos intestinos (sob estrita regulamentação, é claro).
Citações
- "Os micróbios produtores de vitaminas têm o potencial de transformar a nutrição e a medicina, mas primeiro precisamos decifrar suas 'torneiras de emergência' internas", diz a coautora Caroline Aho-Franklin (Universidade Rice).
- “Quando levamos em consideração a depleção do substrato, o modelo finalmente correspondeu ao experimento: as células atingiram um teto natural quando a fonte acabou”, acrescenta Oleg Igoshin.
O que isso significa para a indústria - ponto por ponto
- Ferramentas: Agora há um biossensor para controle preciso e um modelo que calcula corretamente os "gargalos". Isso acelera o ciclo "projeto → verificação".
- Estratégia de escalonamento: Não busque uma "superenzima". Ajuste três botões: alimentação do substrato → níveis de enzima → ordem dos genes. Dessa forma, você tem uma chance maior de ultrapassar o limite natural.
- Tolerabilidade: Os princípios do equilíbrio benefício/toxicidade das quinonas se aplicam também a outros micróbios e vias, desde vitaminas até antibióticos: muitos intermediários reativos causam queda no crescimento.
Onde está a cautela?
Este é um trabalho fundamental sobre bactérias alimentares seguras e em condições de laboratório. Ainda há questões a serem respondidas no workshop: estabilidade da cepa, regulamentação para produtos "funcionais", economia de escala. Mas o roteiro – para onde recorrer e o que medir – já existe.
Resumo
Para produzir mais vitaminas a partir de um micróbio, não basta apenas "dar gás" a uma enzima — também é importante fornecer combustível e montar a fiação correta. O estudo da mBio mostra como ajustar substrato, genes e regulação para transformar o Lactococcus lactis em uma fábrica de K₂ verde — e tornar as vitaminas mais baratas e limpas.
Fonte: Li S. et al. Os benefícios de crescimento e a toxicidade da biossíntese de quinona são equilibrados por um mecanismo regulatório duplo e limitações de substrato, mBio, 11 de agosto de 2025. doi.org/10.1128/mbio.00887-25.
